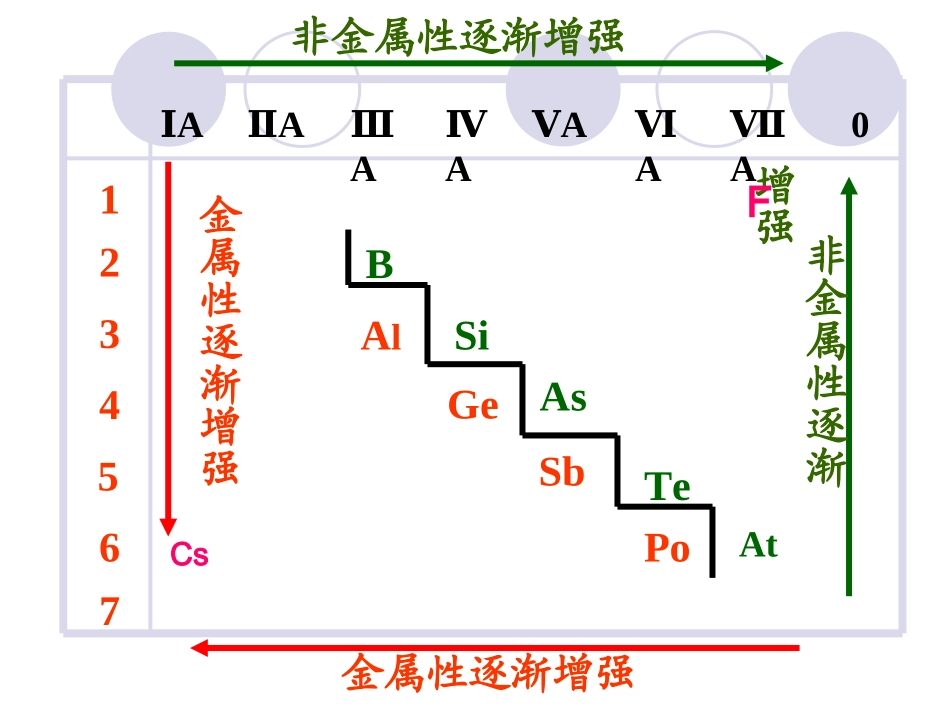
第二节元素周期律(第三课时)1、元素的金属性和非金属性与元素在周期表中的位置关系1BAlSiGeAsSbTe234567ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0PoAt非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强FCs①根据同周期、同主族元素性质的递变规律可推知:金属性最强的元素是铯(Cs),位于第六周期第ⅠA族(左下角),非金属性最强的元素是氟(F),位于第二周期第ⅦA族(右上角)。②位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Al、Si、Ge等。2、元素的化合价与元素在周期表中的位置关系(1)最高正价数=主族序数=最外层电子数(2)最低负价数=主族序数-8=最外层电子数-83、元素的位、构、性三者之间的关系结构位置性质决定反映决定反映决定反映(1)元素周期表是元素周期律的具体表现形式,是学习化学的一种重要工具。(2)可预测或推测元素的原子结构和性质(3)在科学研究和生产上也有广泛的应用见课本P.184、元素周期律的应用和意义练习:1、下列递变情况的是:A.Na、Mg、Al最外层电子数依次增多,其单质的还原性依次减弱B.P、S、Cl最高正价依次升高,对应气态氢化物稳定性增强C.C、N、O原子半径依次增大D.Na、K、Rb氧化物的水化物碱性依次增强不正确C