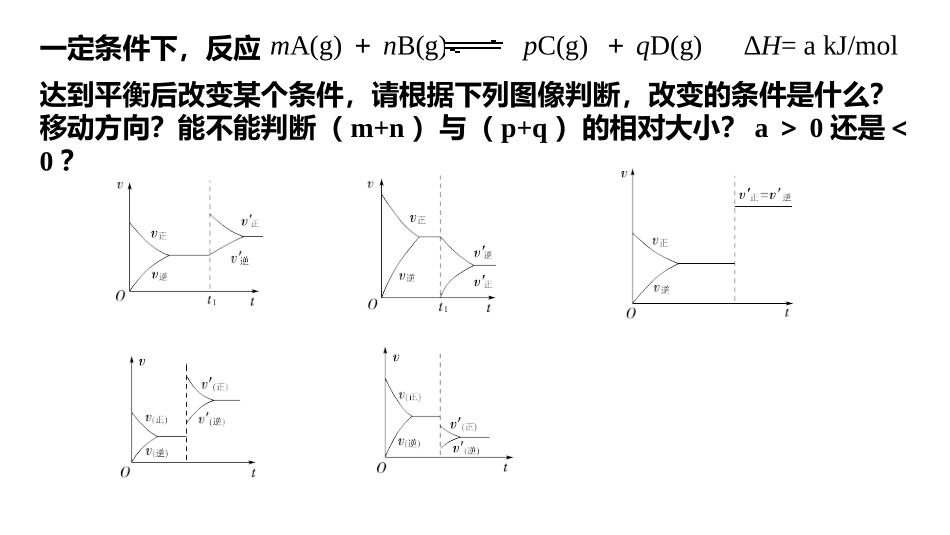
下列物质能导电的是______________,属于强电解质的是________________,属于弱电解质的是_____________,属于非电解质的是____________。a.铜丝b.金刚石c.石墨d.NaCle.盐酸f.蔗糖g.CO2h.Na2Oi.硬脂酸j.醋酸k.HFl.碳酸氢铵m.氢氧化铝n.氯气o.BaSO4p.熔融K2CO3q.NH3r.液态硫酸acepdhloprijkmfgq影响化学平衡移动的因素和化学平衡常数mA(g)+nB(g)pC(g)+qD(g)ΔH=akJ/mol一定条件下,反应达到平衡后改变某个条件,请根据下列图像判断,改变的条件是什么?移动方向?能不能判断(m+n)与(p+q)的相对大小?a>0还是<0?化学平衡移动含义:当一个可逆反应达到平衡后,如果改变_______、_______、_______等反应条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到________________。浓度温度压强新的平衡如果改变影响平衡的一个条件(如浓度、压强或温度),则平衡将向着能够______这种改变的方向移动。勒夏特列原理:减弱电离平衡的建立1.电离平衡在一定条件下(如温度和浓度),弱电解质分子__________的速率和_______________的速率相等时,电离过程达到电离平衡状态。2.建立过程(用vt图象描述)电离成离子离子结合成分子电离平衡的特点(1)电离过程是吸热的。(2)分子、离子共存,这完全不同于强电解质。(3)弱电解质在溶液中的电离都是微弱的。一般来说,电离的分子极少,绝大多数以分子形式存在。如0.1mol·L-1的CH3COOH溶液中,c(H+)在1×10-3mol·L-1左右。思考:影响弱电解质电离平衡的条件有哪些?在一定_____下,当一个可逆反应达到化学平衡时,生成物___________与_________________的比值是一个常数,这个常数就是该反应的化学平衡常数,通常用符号___表示。化学平衡常数温度浓度幂之积反应物浓度幂之积KK=cpC·cqDcmA·cnBmA(g)+nB(g)pC(g)+qD(g)对于一般的可逆反应:平衡常数的表达式为:________________K值越大→平衡体系中生成物所占的比例_____→正向反应进行的程度_____→反应进行得越_____→反应物的转化率_____;反之,就越______,转化率就越小。当______时,该反应进行得就基本完全了。特点:K值只受__________影响,与反应物或生成物的浓度变化无关。意义:温度越大越大完全越大不完全K>105化学平衡常数的应用(1)判断反应进行的程度K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,即该反应进行得越完全,反应物转化率越大;反之,就越不完全,转化率就越小。(2)判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。(3)判断平衡移动方向利用平衡常数可从定量的角度解释恒温下浓度、压强对化学平衡移动的影响。对于可逆反应mA(g)+nB(g)pC(g)+qD(g)在任意状态下,生成物的浓度和反应物的浓度之间的关系用Q=cpC·cqDcmA·cnB表示,则:当Q=K时,反应处于平衡状态,v正=v逆;当Qv逆;当Q>K时,反应向逆反应方向进行,v正