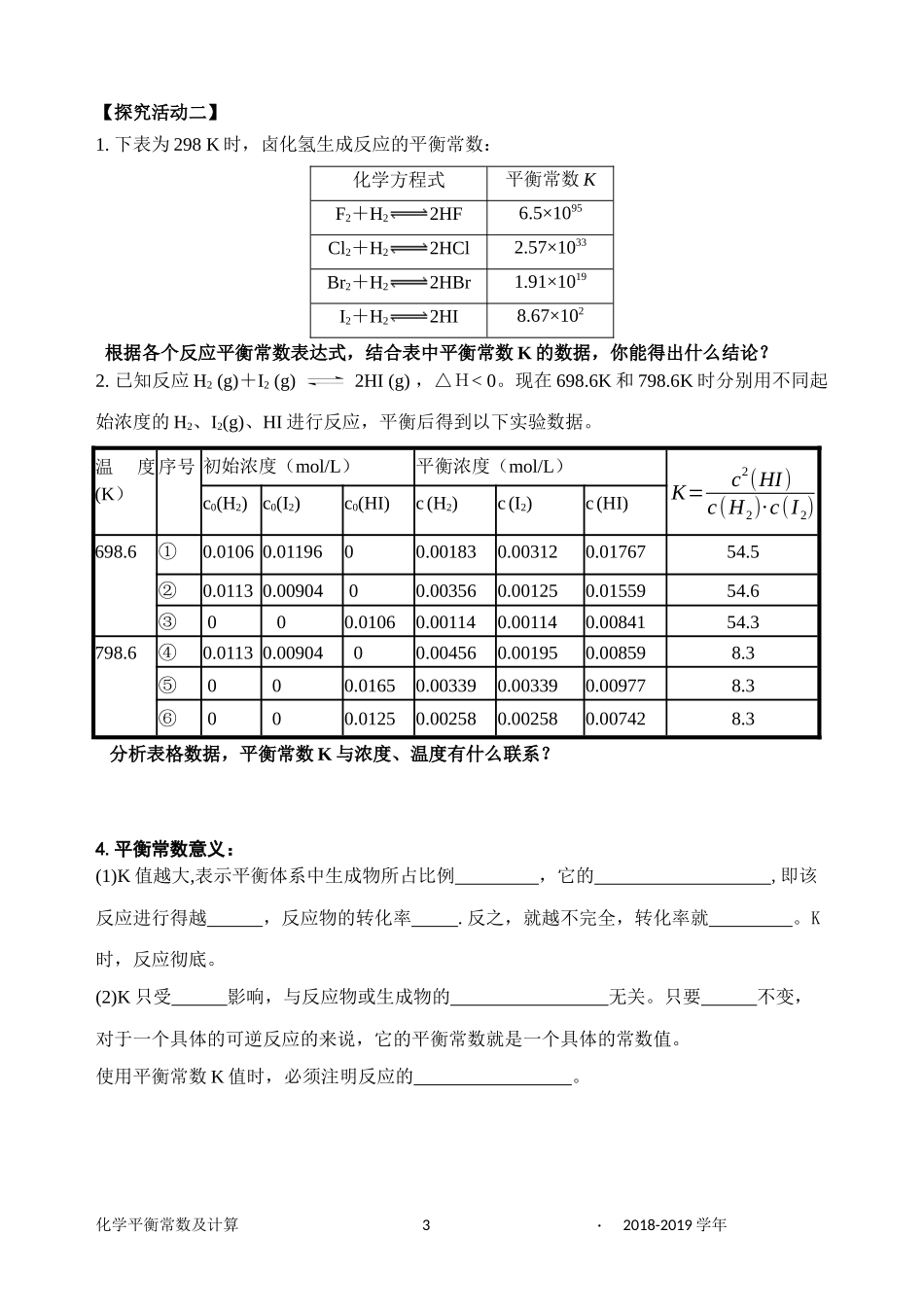
化学平衡常数导学案班级姓名学号【学习目标】1.理解化学平衡常数的含义,能根据化学反应书写化学平衡常数表达式2.能够利用化学平衡常数进行简单的计算。【学习重难点】学习重点:化学平衡常数学习难点:化学平衡常数及其计算一、化学平衡常数【探究活动一】阅读教材,对表中数据进行观察并归纳。在457.6/℃I2+H22HI起始时各物质的浓度(mol·L-1)平衡时各物质的浓度(mol·L-1)平衡常数H2I2HIH2I2HI48.381.197×10-26.944×10-305.617×10-35.936×10-41.270×10-248.611.228×10-29.964×10-303.841×10-31.524×10-41.687×10-249.541.201×10-28.403×10-304.580×10-39.733×10-41.486×10-248.48001.520×10-21.696×10-31.696×10-41.181×10-248.71001.287×10-21.433×10-31.433×10-41.000×10-248.81003.777×10-24.213×10-34.231×10-42.934×10-248.74化学平衡常数平均值48.38结论:化学平衡常数及计算1·2018-2019学年五.化学平衡常数1.定义:在下,当一个可逆反应达到状态时,生成物与反应物的比值是一个常数(简称平衡常数),用符号表示。(以为幂)2.数学表达式对于一般的可逆反应mA(g)+nB(g)pC(g)+qD(g),在一定温度下,K=单位:【练一练1】根据平衡常数的数学表达式,写出下列反应的平衡常数表达式。3.书写平衡常数关系式的规则化学平衡常数及计算2·2018-2019学年【探究活动二】1.下表为298K时,卤化氢生成反应的平衡常数:化学方程式平衡常数KF2+H22HF6.5×1095Cl2+H22HCl2.57×1033Br2+H22HBr1.91×1019I2+H22HI8.67×102根据各个反应平衡常数表达式,结合表中平衡常数K的数据,你能得出什么结论?2.已知反应H2(g)+I2(g)2HI(g),△H<0。现在698.6K和798.6K时分别用不同起始浓度的H2、I2(g)、HI进行反应,平衡后得到以下实验数据。温度(K)序号初始浓度(mol/L)平衡浓度(mol/L)K=c2(HI)c(H2)·c(I2)c0(H2)c0(I2)c0(HI)c(H2)c(I2)c(HI)698.6①0.01060.0119600.001830.003120.0176754.5②0.01130.0090400.003560.001250.0155954.6③000.01060.001140.001140.0084154.3798.6④0.01130.0090400.004560.001950.008598.3⑤000.01650.003390.003390.009778.3⑥000.01250.002580.002580.007428.3分析表格数据,平衡常数K与浓度、温度有什么联系?4.平衡常数意义:(1)K值越大,表示平衡体系中生成物所占比例,它的,即该反应进行得越,反应物的转化率.反之,就越不完全,转化率就。K时,反应彻底。(2)K只受影响,与反应物或生成物的无关。只要不变,对于一个具体的可逆反应的来说,它的平衡常数就是一个具体的常数值。使用平衡常数K值时,必须注明反应的。化学平衡常数及计算3·2018-2019学年【探究活动三】平衡常数与温度的关系1.I2(g)+H2(g)2HI(g)H△<0平衡常数与温度的关系如下:温度425.6℃427.6℃525.6℃平衡常数54.4748.748.29已知N2O4(g)2NO2(g)△H>0科学家通过严密的实验测得下表中的数据分析以上两个表格数据中温度和平衡常数的关系,能得出什么变化规律?【探究活动四】判断正在进行的可逆反应是否平衡及反应向何方向进行某恒容密闭容器发生如下反应N2(g)+3H2(g)2NH3(g),已知在485K测得该反应的平衡常数为16L2/mol2若该温度下,一开始往容器内充入1.0mol/LN2和1.0mol/LH2。t1时,测得容器中N2、H2、NH3的浓度分别为0.8mol/L、0.4mol/L、0.4mol/L。在t1时刻,容器中的反应是否达到平衡状态?5.平衡常数K的应用(1)根据K值随温度变化规律,可判断可逆反应的a.若升高温度,K值,则正反应为反应,△H0;b.若升高温度,K值,则正反应为反应,△H0。(2)K值的大小可反映化学反应进行的进行程度。(3)比较Q和K的大小,可判断正在进行的可逆反应是否平衡及反应向何方向进行:对于可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:Q=,叫做该反应的浓度商。Q=K,反应处于Q>K,反应向进行Q