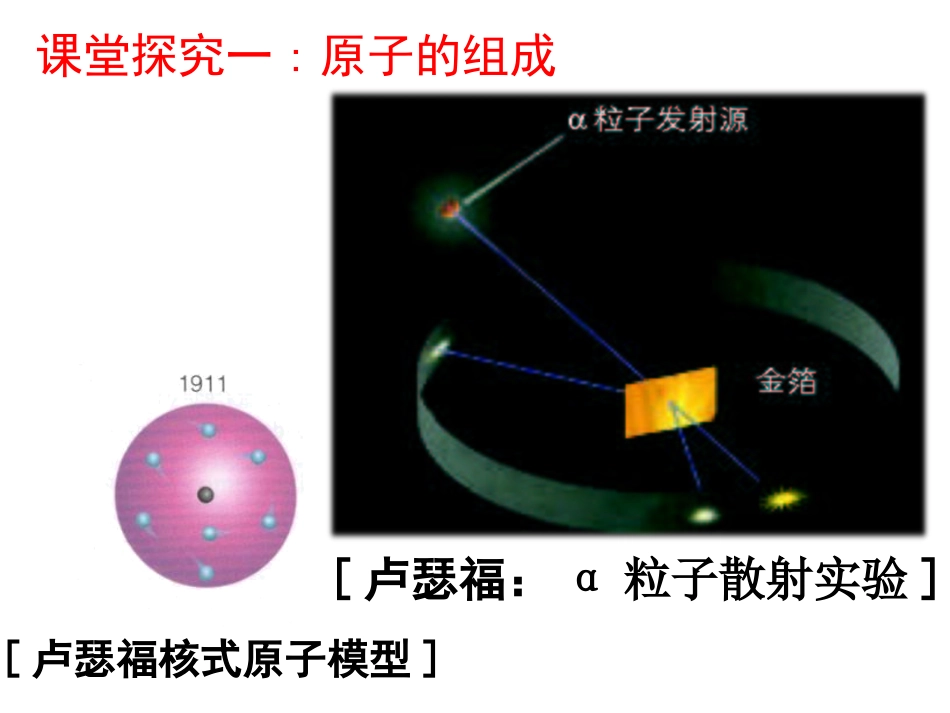
必修2第一章第一节原子结构化学变化中的最小微粒是什么?想一想原子你知道原子内部的结构是怎样的吗?完成预习案中的内容预习检测:ADCBCCDB[卢瑟福:α粒子散射实验]课堂探究一:原子的组成[卢瑟福核式原子模型]一原子核核素1原子核的构成原子原子核核外电子(负电)质子(正电)中子(不带电)交流·研讨下表列出的是构成原子的微粒—电子﹑质子和中子的基本数据。微粒电子质子中子质量/kg9.109×10-311.673×10-271.675×10-27相对质量0.00054841.0071.008电量/C1.602×10-191.602×10-190电荷-1+10请根据表中所列的数据讨论:1在原子中,质子数,核电荷数和核外电子数之间存在着什么关系?为什么?2原子的质量主要由哪些微粒决定?3如果忽略电子的质量,质子,中子的相对原子质量分别取其近似整数值,那么,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?结论:核电荷数=质子数=核外电子数质子数(Z)+中子数(N)=质量数(A)注意:(1)质量数是原子的质量数,不是元素的质量数.一种元素可以有多种不同的原子,每种原子都有自己的质量数(如14C、13C、12C)。(2)原子的质量数与原子的相对原子质量的近似整数值相等。核电荷数=核内质子数=核外电子数思考:如果是离子,则上述关系如何表达?原子中:原子得电子阴离子失电子阳离子质子数=电子数-|电荷数|质子数=电子数+电荷数质量数质子数微粒HS2-11练习:中子数电子数23123235451801Na+1616801135Br10XAZ——元素符号质量数——核电荷数——(核内质子数)表示原子组成的一种方法Na2311例如思考:168O2-各数字所表示的含义?请看下列表示ab+dXc+eabcde各代表什么a——代表质量数;b——代表质子数既核电荷数;c——代表离子的所带电荷数;d——代表化合价e——代表原子个数探究二:元素、核素、同位素探究二:元素、核素、同位素⑴⑴具有相同具有相同核电荷数(质子数核电荷数(质子数)的同)的同一类一类原原子叫子叫元素元素。。⑵⑵具有一定数目的具有一定数目的质子质子和一定数目的和一定数目的中子中子的的一种原子,叫一种原子,叫核素核素。。⑶⑶质子数相同而中子数不同质子数相同而中子数不同的的同一元素同一元素的不的不同核素(原子同核素(原子))互为互为同位素同位素。。⑷⑷了解常见的同位素以及它们在有关领域的了解常见的同位素以及它们在有关领域的重要用途。重要用途。氕(H)氘(D)氚(T)质子中子电子思考:1、决定同位素的因素是?2、同位素原子构成的物质的性质有何异同?3、到目前为止,人类已经发现的元素有112种,也就是发现了112种原子,对吗?为什么?氢的三种原子完成学案中的小结完成学案中的小结44、元素、核素、同位素的比较、元素、核素、同位素的比较回顾:什么是同素异形体?回顾:什么是同素异形体?探究三:核外电子排布+11原子核核电荷数281电子层该电子层上的电子数排布规律:1、能量最低原则2、每层最多容纳的电子数为2n2(n代表电子层数);3、最外层电子数不超过8个(第一层为最外层时,电子数不超过2个).次外层不超过18个,倒数第三层不超过32个。迁移·应用1、如何绘制原子结构示意图?绘制下列微粒的结构示意图Na、Na+、F、F-、K、Ca2、金属钠﹑金属镁在化学反应中常表现出还原性,而氧气﹑氯气在化学反应中常表现出氧化性,你能用原子结构的知识对这一事实进行解释吗?BeAr;C、O、Ne;HBeAl;LiSi;LiNaK10电子:分子:NeHFH2ONH3CH4阳离子:Na+Mg2+Al3+NH4+H3O+阴离子:O2-F-OH-N3-NH2-18电子:分子ArHClH2SPH3SiH4F2H2O2C2H6CH3OHN2H4阳离子:Ca2+K+阴离子:S2-HS-Cl-O22-3、根据1-20号原子的结构示意图判断下列原子4、含有10个(或18个)电子的微粒跟踪训练1、下列说法正确的是()A、原子核都是由质子和中子构成的B、不同元素原子的质量数一定不等C、质子数决定元素的种类,质子数和中子数决定原子的种类D、质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同2、几种微粒具有相同的核电荷数,则可说明()A、可能属于同一种元素B、一定是同一种元素C、一定不是同一种元素D、核外电子数一定相等CANe和H2ONa和NH4+3、质量数为37的原子,应该有()A、18个质子,19个中子,19个电子B、18个质...