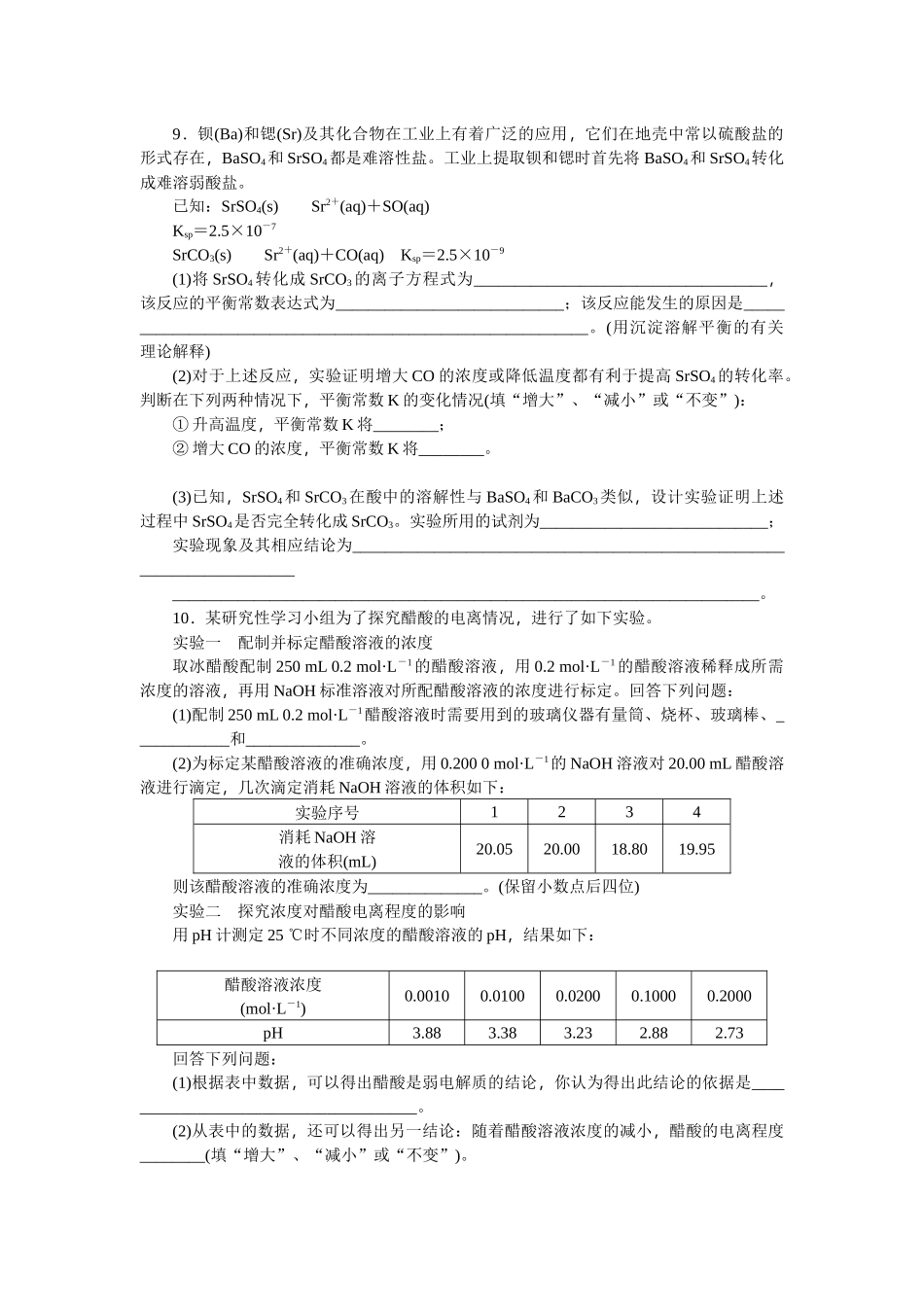
化学作业五水溶液中的离子平衡(二)一、选择题1.已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是()A.该溶液的pH=4B.升高温度,溶液的pH增大C.此酸的电离平衡常数约为1×10-7D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍2.已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.001000mol/L的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO的浓度是5.000×10-3mol/L,此时溶液中Cl-的物质的量浓度是()A.8.90×10-6mol/LB.1.36×10-5mol/LC.1×10-5mol/LD.4.45×10-2mol/L3.已知:常温下浓度为0.1mol·L-1的下列溶液的pH如下表:溶质NaFNaClONa2CO3pH7.59.711.6下列有关说法正确的是()A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HFB.若将CO2通入0.1mol·L-1Na2CO3溶液中至溶液呈中性,则溶液中:2c(CO)+c(HCO)=0.1mol·L-1C.根据上表,水解方程式ClO-+H2OHClO+OH-的平衡常数K≈10-7.6D.向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-)4.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是()①常温下,pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度一定降低②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1③pH相等的下列溶液(a.CH3COONa、b.C6H5ONa、c.NaHCO3、d.NaOH),其物质的量浓度由小到大顺序为d、b、c、a④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO)⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为KW;则三者关系为Ka·Kh=KW⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7A.③⑤⑥B.③④⑥C.④⑤⑥D.①②④5.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列说法正确的是()A.a点对应的溶液和c点对应的溶液pH大小:pH(c)>pH(a)B.d点对应的溶液中大量存在:K+、Ba2+、NO、I-C.25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L的NaF溶液与0.1mol/L的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-)D.如b点对应的溶液中只含NaHA,则溶液中粒子浓度大小:c(HA-)>c(H2A)>c(H+)>c(A2-)6.下列说法正确的是()A.向50mL1mol·L-1的盐酸中加入烧碱,水的KW不变B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+)D.常温下0.1mol·L-1的HA溶液中=1×10-8,则0.01mol·L-1HA溶液中c(H+)=1×10-4mol·L-17.某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是()A.pH=1和pH=2的盐酸,c(H+)之比为1∶2B.物质A三态间的转化如下:A(g)―→A(l)―→A(s),则该转化过程中ΔS<0C.pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度相同二、非选择题8.常温下有0.1mol/L的以下几种溶液(①H2SO4溶液、②NaHSO4溶液、③CH3COOH溶液、④HCl溶液、⑤HCN溶液、⑥NH3·H2O),其中几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:①H2SO4溶液中HSO②NaHSO4溶液中HSO③CH3COOH④HCl溶液10%29%1.33%100%(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同)________。(2)常温下,将足量的锌粉投入等体积pH=1的表格中几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是________。(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3COOH应选用________作指示剂,若终点时溶液pH=a,则由水电离出的c(H+)为________。(4)在25℃时,将bmol·L-1的KCN溶液与0.01mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度b________0.01mol·L-1(填“>”、“<”或“=”);用...