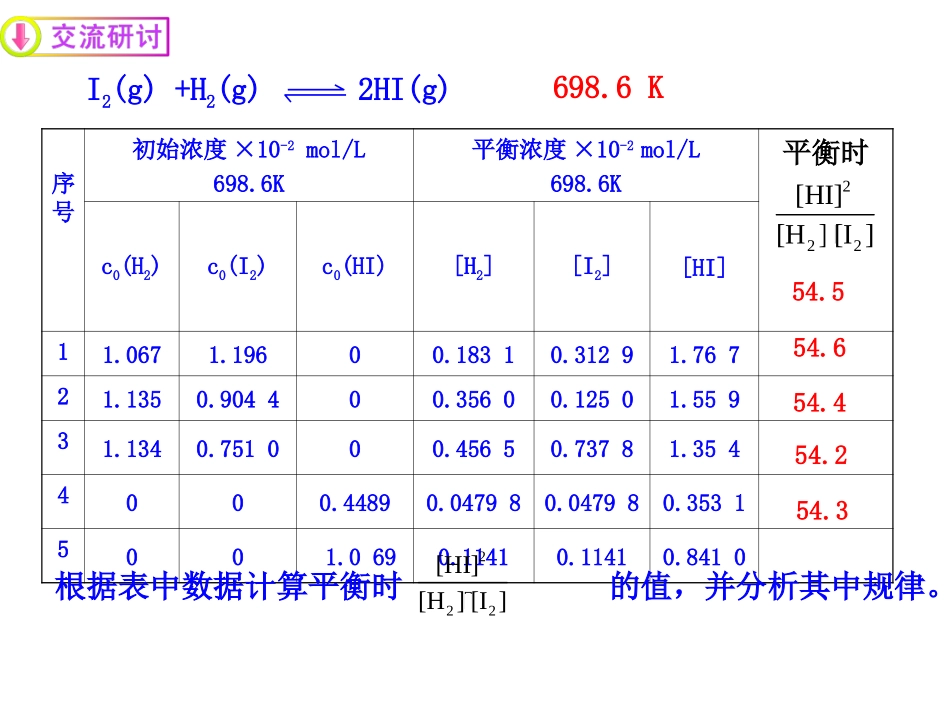
第2节化学反应的限度第1课时化学平衡常数可逆反应进行到一定程度就会达到平衡状态,你知道这时可逆反应到底进行到什么程度吗?平衡体系中反应物和生成物各占多少吗?为了更准确地了解可逆反应的进程,定量地描述化学反应的限度,引入新的概念——化学平衡常数。序号初始浓度×10-2mol/L698.6K平衡浓度×10-2mol/L698.6K平衡时c0(H2)c0(I2)c0(HI)[H2][I2][HI]11.0671.19600.18310.31291.76721.1350.904400.35600.12501.55931.1340.751000.45650.73781.3544000.44890.047980.047980.35315001.0690.11410.11410.8410222[HI][H][I]I2(g)+H2(g)2HI(g)54.554.654.454.3根据表中数据计算平衡时的值,并分析其中规律。222[HI][H][I]698.6K54.2对比730.6K时的相关数据其它平衡体系的数据进行分析,都有类似的关系。(1)相同温度,达到化学平衡状态时的数值相同吗?(2)这个常数与反应的起始浓度大小有关吗?(3)这个常数与正向建立还是逆向建立平衡有关系吗?(4)这个常数受哪个因素的影响?222[HI][H][I]分析实验数据,思考下列问题:无关,即与平衡建立的途径无关无关相同,是个常数温度[C]c[D]d[A]a[B]b化学平衡常数K=意义:反映了化学反应可能进行的程度一、化学平衡常数K在一定温度时,可逆反应aA(g)+bB(g)cC(g)+dD(g)达到平衡状态时对于同类型的反应,平衡常数的数值越大,说明反应进行得越完全。通常认为:K>105,反应可以进行得比较完全;K<10-5,反应很难进行;K在10-5~105之间,是典型的可逆反应。7如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式(固体和纯液体浓度为1)化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。平衡常数表达式书写注意事项C(s)+H2O(g)CO(g)+H2(g)[CO][H2][H2O]K=写出下表中各反应的平衡常数表达式反应K单位11/2N2(g)+3/2H2(g)NH3(g)(mol·L-1)-12N2(g)+3H2(g)2NH3(g)(mol·L-1)-232NH3(g)N2(g)+3H2(g)(mol·L-1)24NH3·H2O(aq)NH4+(aq)+OH-(aq)5FeO(s)+CO(g)Fe(s)+CO2(g)6AgCl(s)Ag+(aq)+Cl-(aq)2321223HNNH32223HNNH23223NHHNOHNHOHNH234COCO2ClAgmol·L-1(mol·L-1)211.对于某一化学反应,K的表达式唯一吗?2.对于系数一定的化学反应,K的数值受何影响?3.对于某一可逆反应,其正反应和逆反应的K有何关系?互为倒数,单位不同。不唯一。取决于化学方程式的系数。平衡常数只与温度有关。只有温度变,K才会变。1.判断可逆反应是否达到平衡状态cc(C)·cd(D)ca(A)·cb(B)任意状态时:浓度商Q=[C]c[D]d[A]a[B]b达到平衡状态时K=在某温度下,用浓度商Q与K比较大小来判断是否达到平衡。对于可逆反应aA(g)+bB(g)cC(g)+dD(g)二、化学平衡常数的应用cc(C)·cd(D)ca(A)·cb(B)浓度商Q=Q=K反应状态。QK反应状态。平衡状态反应正向进行反应逆向进行[C]c[D]d[A]a[B]b达到平衡状态时K=任意状态时:可逆反应aA(g)+bB(g)cC(g)+dD(g)不同温度时,反应H2(g)+I2(g)2HI(g)的浓度平衡常数与温度的关系如下:温度623K698K763K浓度平衡常数66.954.445.9通过改变温度,平衡常数大小的变化趋势可以判断上可逆反应的正方向是放热反应.2.利用K可判断反应的热效应(1)若升高温度,K值增大,则正反应为吸热反应(2)若升高温度,K值减小,则正反应为放热反应[HI]2[H2][I2]K=13高炉炼铁中发生的反应有:FeO(s)+CO(g)Fe(s)+CO2(g)ΔH<0(1)该反应的平衡常数表达式K=;(2)已知1100℃时,K=0.263。1100℃时,测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态。此时反应速率是v正___v逆(填“>”“<”或“=”)否>2[CO][CO]判断可逆反应平衡移动的方向平衡时,K=[B]2[A]加入一定量的A后,Q