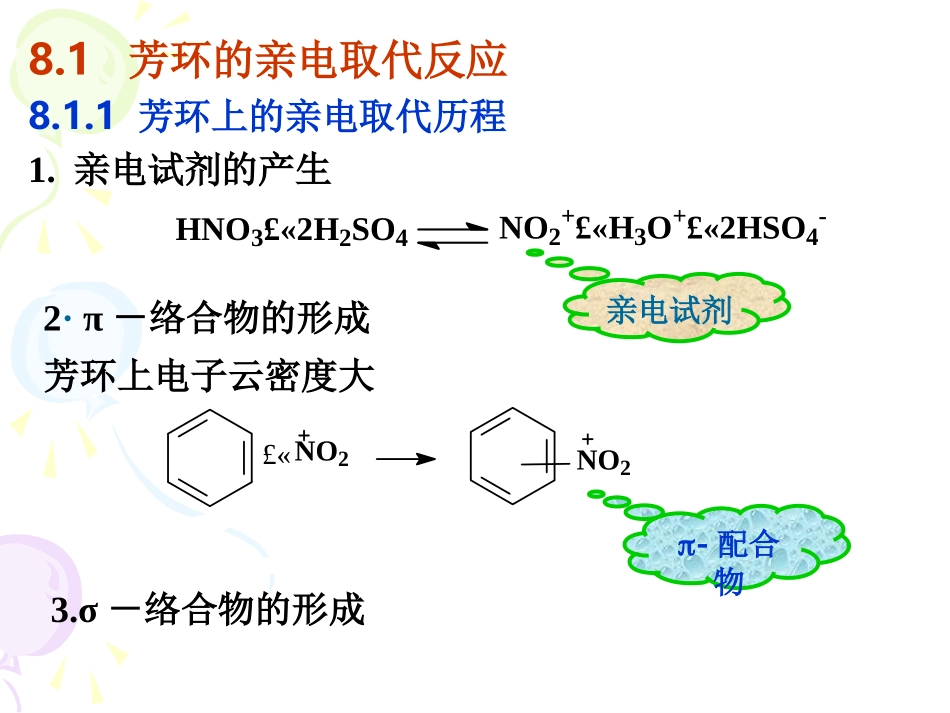
第八章芳环上的亲电第八章芳环上的亲电和亲核取代反应和亲核取代反应CCCCCCHHHHHH芳环上离域的π电子的作用,易于发生亲电取代反应,只有当芳环上引入了强吸电子基团,才能发生亲核取代反应。8.1芳环的亲电取代反应8.1.1芳环上的亲电取代历程1.亲电试剂的产生HNO3£«2H2SO4NO2+£«H3O+£«2HSO4-亲电试剂2·π-络合物的形成芳环上电子云密度大£«NO2NO2-配合物3.σ-络合物的形成NO2+HNO2¦Ò£ÂçºÏÎïÂýsp3杂化4.消去H+,恢复芳环的Kekulè结构HNO2-H+NO2¿ìσσ-络合物的证据-络合物的证据CH3£«CH3CH2F£«BF3CH3CH2CH3HBF4-通过红外和核磁等可鉴定其结构芳香稳定性¡÷CH3EtCH3CH3mp-15C黄色CH3CH3CH3EtFBF3,-80¡æCH3HEtCH3CH3BF4-加成--消除历程σ-络合物生成是决定反应速率的步骤这种机理称:Ar-SE8.1.2苯环上亲电取代反应的定位规律从反应速度和取代基进入的位置进行考虑1.第一类定位基(邻、对位定位基)Ö»î»ùNH2NHRNR2OHORNHCROPhRFClBrIÖ¶ۻù-I<+C效应-I,+C效应但–I>+C2.第二类定位基(间位定位基)均为致钝基均为致钝基NO2NR3COOHCOORSO3HCNCHOCROCCl38.1.3定位规律在有机合成中的应用8.1.4典型的芳香亲电取代反应1.硝化反应HNO3-H2SO4为常见的硝化试剂HNO3£«2H2SO4NO2+£«H3O+£«2HSO4-真正的硝化试剂混酸体系有强氧化性OH20%HNO3OHNO2£«OHNO2如用混酸将得氧化产物同时还有部分氧化产物同时还有部分氧化产物NH2ŨHNO3ŨH2SO4NH3HSO4-NO2HNO3/CCl4低温时的硝化速度较快OCH3£«HNO3CH3COOHCH3ONO22.磺化反应亲电试剂为SO3或SO3H(共轭酸)£«SO3HHSO3HÂýSO3H-H+¿ì+SOOOHSO3-+SO3--H+特点:(1)可逆反应,可用于芳环的定向取代(占占位位));(2)置换反应,合成一些难于合成的物质。CH3H2SO4¡÷SO3HCH3NO2CH3SO3HHNO3H2SO4BrCH3SO3HCuBrH2OH2SO4CH3BrSO3HCH3N2Cl-NaNO2,HCl0-5¡æFe/HClNH2CH3SO3HPhOHSO3H2SO4OHSO3HHO3SSO3HHNO3OHNO2NO2NO2X2£«FeX3XXFeX3¦Ä+¦Ä-XXFeX3¦Ä+¦Ä-+ÂýFeX4-HX¿ìH+X(2)N-卤代酰胺或N-卤代磺酰胺作卤化剂NBSCCNOOBrCH3CNHBrOCH3CNHClOCH3SO2NCl23.卤化反应(1)卤素作卤化剂Br2+FeBr3BrBrFeBr3¦Ä¦Ä卤化性能较差,只与活泼芳烃反应,可避免氧化反应发生(对芳胺和酚特别有用)FeCl3HClN-OO£«Br+NOOBr亲电试剂PhCH3£«NBSFeCl360¡æBrCH3CH3SO2NCl2£«NHCCH3OCHCl3.HCl20¡æClNHCCH3O£«NHCCH3ClO£«CH3SO2NH2Ö÷´Î需要在极性溶剂和极性催化剂存在下发生而在非极性而在非极性CClCCl44等溶剂中是自由基引发剂等溶剂中是自由基引发剂NOOBr(PhCOO)2CCl4NOO£«BrBrCH2CH3CHBrCH3+自由基取代反应NH2+(CH3CO)2ONHCOCH3KClO3,HClNHCOCH3ClClH3O+NH2ClClNH2+(CH3CO)2ONHCOCH3HNO3NHCOCH3O2NH3O+NH2O2NNH2*H2SO4-H2ONH*SO3HH+NH2*SO3HNH2HO3SH-H+NH2SO3H180oCNH2SO3H邻位和对位定向比:CH3HNO3H2SO4NO2+BF4-/CH3CNm%o%%p172.36033769229Ïà¶ÔËÙÂÊ1)亲电试剂的活性越高,选择性越低:2)空间效应越大,对位产物越多:C(CH3)3H2SO4C(CH3)3SO3H100%XXo%p%m%F12880Cl30691I32608X具有-I效应,使邻位的电子云密度降低。FClBrI电负性依次降低-I效应依次减小电子云密度降低的位置是不利于E+进攻的。溶剂效应:CH3CClOAlCl3CS2CCH3PhNO2CCH3OOE+被硝基苯溶剂化,体积增大。较大的空间效应使它进入1位。de螯合作用NO2NO2OCH2CH2OCH3-NO3-(ÁÚ£©69%£¨¶Ô£©28%CH2NO2CH2OCH3CH2CH2OCH3NO2HNO2CH2CH2OCH3-H+²úÎï能够发生螯合效应的条件:1〕杂原子能与试剂结合;2)所形成环为五员环或六员环。f原位取代原位取代(Ipso取代):在芳环上已有取代基的位置上,发生取代作用-Ipso效应:CH3CH(CH3)2NO2OAcAc2OCH3CH(CH3)2NO2+CH3CH(CH3)2NO2+CH3NO282%8%10%取代基消除的难易程度取决于其容纳正电荷的能力。+CH(CH3)2比较稳定,异丙基容易作为正离子消除。4.Fridel-Crafts反应(1)烃基化R+£«AlCl4-亲电试剂产生RCl£«AlCl3RClAlCl3¦Ä+¦Ä-ROH£«HXX-ROH2H2OR+RCHCH2£«H2SO4RCHCH3£«HSO4-催化剂活性AlCl3>FeCl3>SbCl5>SnCl4>BF3>TiCl4>ZnCl2特点...