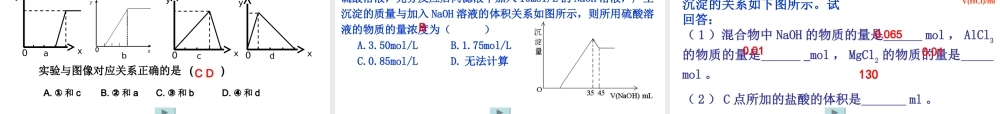
考 纲 要 求• 掌握铝及其重要化合物的相互转化关系及应用铝三角及其应用 一、铝三角:(铝的主要不同粒子间的相互转化关系)一、铝三角:(铝的主要不同粒子间的相互转化关系)AlAl3+3+AlOAlO22——AlAl (( OOHH )) 33【书写】有关离子方程式:C 、 Al3+ 与 AlO2— 的相互转化 ⑤ Al3+→AlO2— : ⑥ AlO2—→Al3+ : ; B 、 AlO2— 与 Al(OH)3 的相互转化③ Al(OH)3→AlO2— : ④ AlO2—→Al(OH)3 : ; A 、 Al3+ 与 Al(OH)3 的相互转化 ① Al(OH)3→Al3+ : ② Al3+→Al(OH)3 : 。 ①②③④⑤⑥Al2O3AlAl 【讨论】根据下图提供的“铝三角”讨论制取Al(OH)3 的可能途径有那些?途径 1 :铝盐与碱液反应 ① Al3 + Al(OH)3 OH -适量 ② Al3 + Al(OH)3 NH3 ·H2O足量途径 2 :偏铝酸盐与酸反应: ① AlO2- Al(OH)3 H+适量 ② AlO2- Al(OH)3 CO2适量途径 3 :铝盐与偏铝酸盐反应Al3+AlO2-Al(OH)31. Al(OH)3 的制备及试剂选择问题Al3+Al(OH)3二、“铝三角”的应用AlOAlO22—— Al(OH)3 是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的 Al(OH)3。他们分别设计了两种实验方案: 方案一:Al Al2(SO4)3 Al(OH)3 方案二:Al NaAlO2 Al(OH)3 (1)从节约药品的角度思考,你认为哪一种方案较好?__________,方案一和方案二共同存在的问题是_________________________。 (2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式__________________________________________________ ____________________________________________________________。 ――→H2SO4 ――→NaOH ――→NaOH ――→H2SO4 第二步操作很难控制试剂用量方案二较好2Al+3H2SO4===Al2(SO4)3+3H2↑;2Al+2NaOH+ 2H2O===2NaAlO2+3H2↑;Al3++3AlO-2 +6H2O===4Al(OH)3↓ 【即时应用】 【讨论】 室温下,强酸性和强碱性溶液中都不能大量共存的 离子组是( ) A.K+ 、 Na+ 、 AlO2- 、 SO42- B.Mg2+ 、 Fe3+ 、 NO3- 、 SO42- C.NH4+ 、 Al3+ 、 H+ 、 Cl- D.Al3+ 、 SO42- 、 HCO3- 、 Na+D Al3+ 与 OH- 、 CO32- 、 HCO3- 、 AlO2- 、 S2- 、 HS- 、 ClO- 、 SiO32- 等不能大量共存AlO2- 与 H+ 、 Al3+ 、 Fe3+ 、 NH4+ 、 HCO3- ...