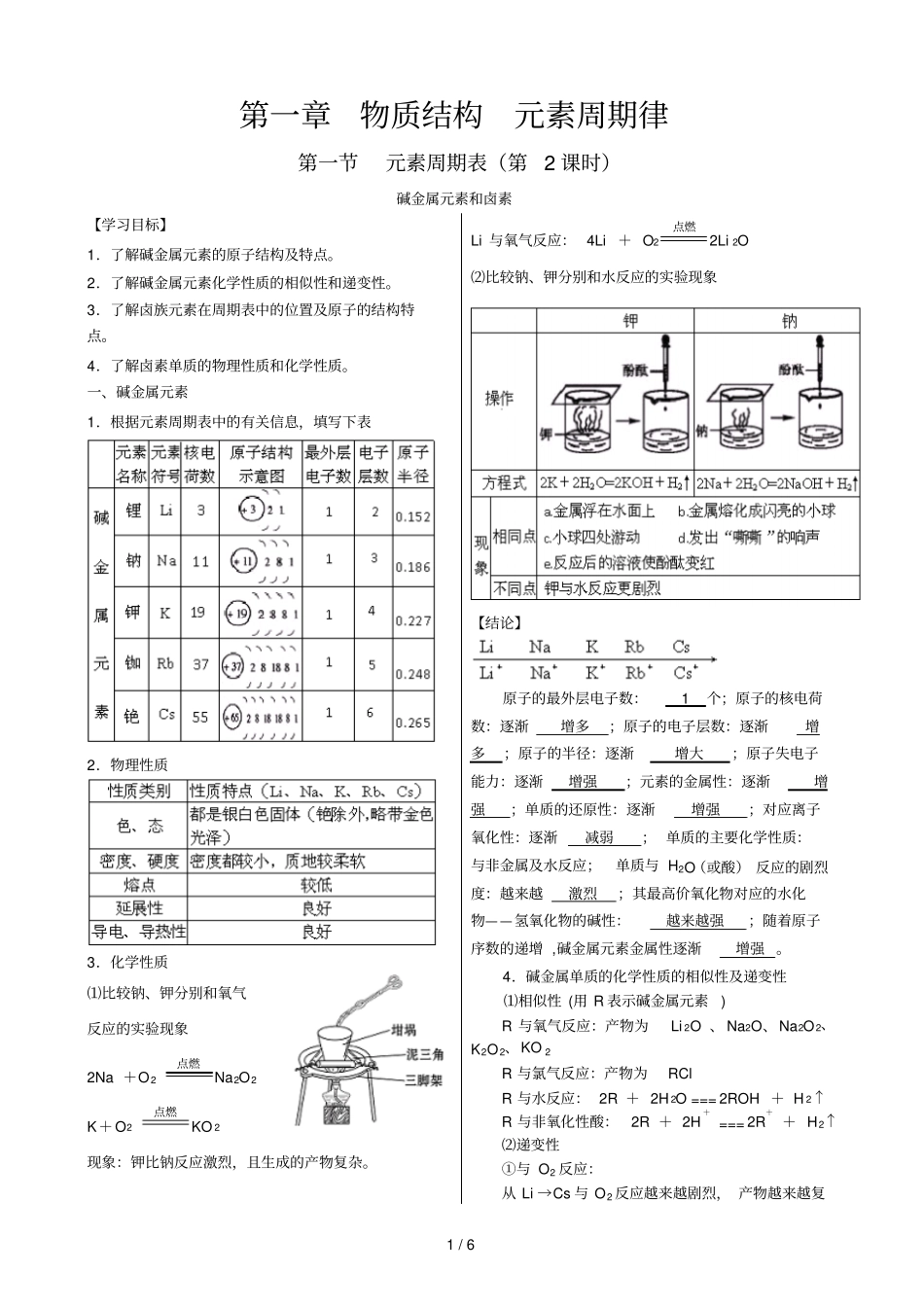
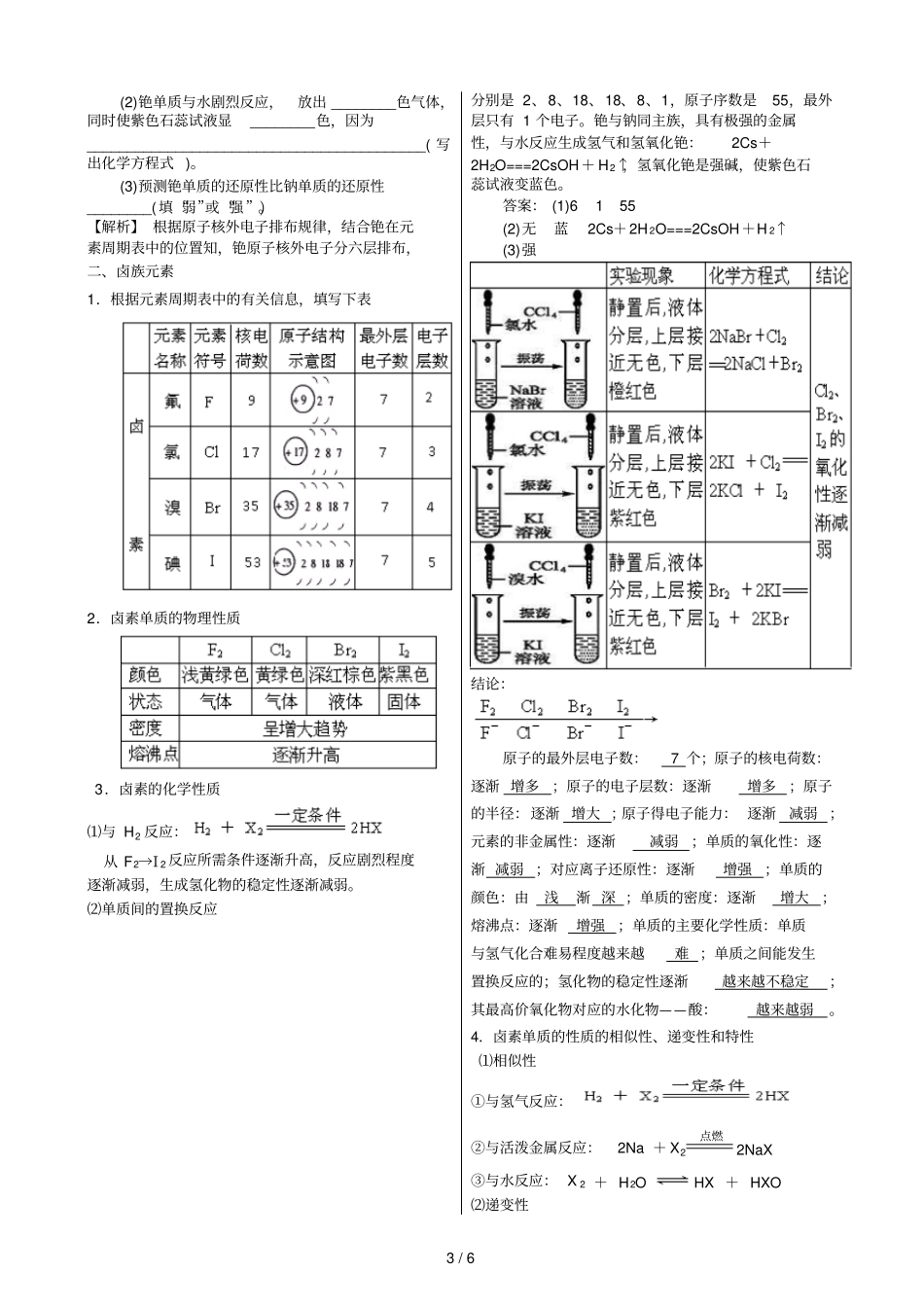
1 / 6 第一章物质结构元素周期律第一节元素周期表(第2 课时)碱金属元素和卤素【学习目标】1.了解碱金属元素的原子结构及特点。2.了解碱金属元素化学性质的相似性和递变性。3.了解卤族元素在周期表中的位置及原子的结构特点。4.了解卤素单质的物理性质和化学性质。一、碱金属元素1.根据元素周期表中的有关信息,填写下表2.物理性质3.化学性质⑴比较钠、钾分别和氧气反应的实验现象2Na +O2点燃Na2O2 K+O2点燃KO 2现象:钾比钠反应激烈,且生成的产物复杂。Li 与氧气反应: 4Li + O2点燃2Li 2O⑵比较钠、钾分别和水反应的实验现象【结论】原子的最外层电子数:1 个;原子的核电荷数:逐渐增多;原子的电子层数:逐渐增多;原子的半径:逐渐增大;原子失电子能力:逐渐增强;元素的金属性:逐渐增强;单质的还原性:逐渐增强;对应离子氧化性:逐渐减弱; 单质的主要化学性质:与非金属及水反应;单质与 H2O(或酸) 反应的剧烈度:越来越激烈;其最高价氧化物对应的水化物——氢氧化物的碱性:越来越强;随着原子序数的递增 ,碱金属元素金属性逐渐增强 。4.碱金属单质的化学性质的相似性及递变性⑴相似性 (用 R 表示碱金属元素) R 与氧气反应:产物为Li 2O 、 Na2O、Na2O2、K2O2、KO 2R 与氯气反应:产物为RCl R 与水反应: 2R + 2H 2O === 2ROH + H 2↑R 与非氧化性酸:2R + 2H+=== 2R++ H2↑⑵递变性①与 O2 反应:从 Li →Cs 与 O2 反应越来越剧烈, 产物越来越复2 / 6 杂。如 Li 与 O2 反应只能生成Li 2O,Na 与 O2 反应还可以生成Na2O、Na2O2,而 K 与 O2 反应能够生成K 2O、K 2O2、KO 2 等。②与 H 2O(或酸 )的反应:从 Li →Cs,与 H2O(或酸 )反应越来越剧烈,如K与 H 2O 反应可能会发生轻微爆炸,Rb 与 Cs 遇水发生剧烈爆炸。③最高价氧化物对应水化物的碱性:碱性: LiOH