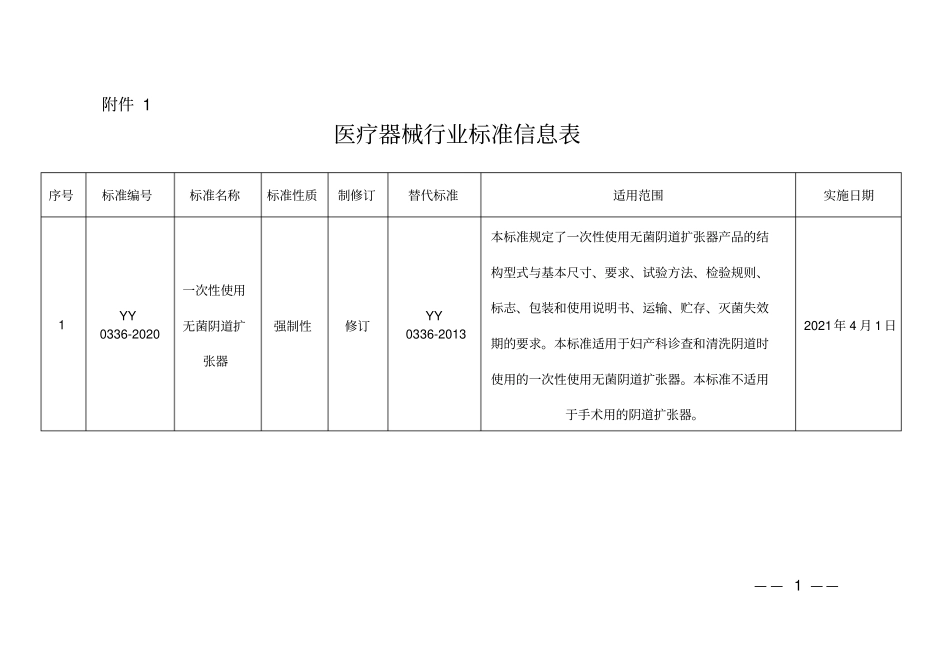
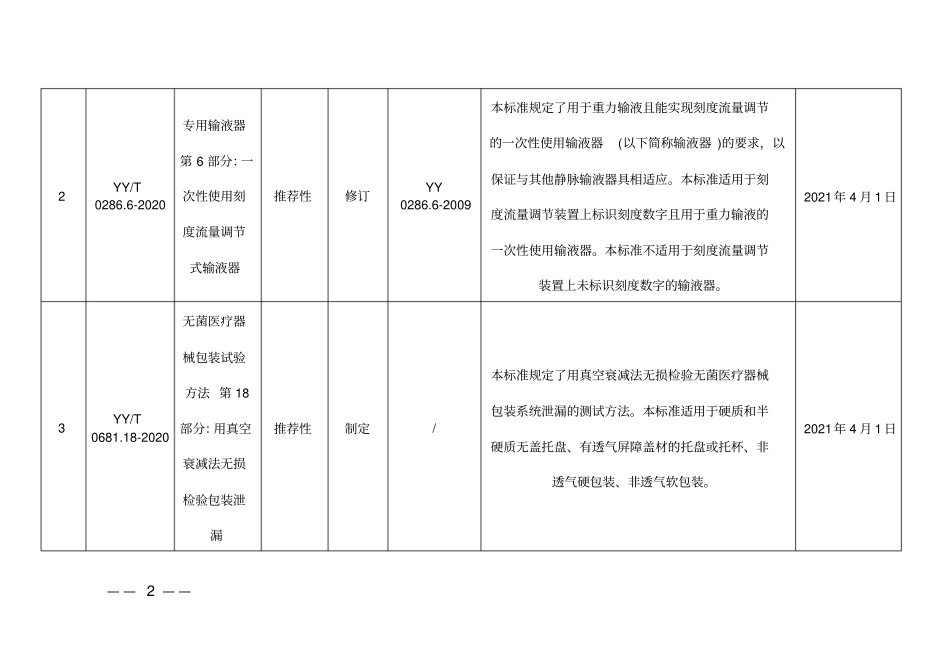
— — 1 — —附件 1 医疗器械行业标准信息表序号标准编号标准名称标准性质制修订替代标准适用范围实施日期1 YY 0336-2020 一次性使用无菌阴道扩张器强制性修订YY 0336-2013 本标准规定了一次性使用无菌阴道扩张器产品的结构型式与基本尺寸、要求、试验方法、检验规则、标志、包装和使用说明书、运输、贮存、灭菌失效期的要求。本标准适用于妇产科诊查和清洗阴道时使用的一次性使用无菌阴道扩张器。本标准不适用于手术用的阴道扩张器。2021年 4 月 1 日— — 2 — —2 YY/T 0286.6-2020 专用输液器第 6 部分:一次性使用刻度流量调节式输液器推荐性修订YY 0286.6-2009 本标准规定了用于重力输液且能实现刻度流量调节的一次性使用输液器(以下简称输液器 )的要求,以保证与其他静脉输液器具相适应。本标准适用于刻度流量调节装置上标识刻度数字且用于重力输液的一次性使用输液器。本标准不适用于刻度流量调节装置上未标识刻度数字的输液器。2021年 4 月 1 日3 YY/T 0681.18-2020 无菌医疗器械包装试验方法 第 18部分:用真空衰减法无损检验包装泄漏推荐性制定/ 本标准规定了用真空衰减法无损检验无菌医疗器械包装系统泄漏的测试方法。本标准适用于硬质和半硬质无盖托盘、有透气屏障盖材的托盘或托杯、非透气硬包装、非透气软包装。2021年 4 月 1 日— — 3 — —序号标准编号标准名称标准性质制修订替代标准适用范围实施日期— — 4 — —4 YY/T 0771.1-2020 动物源医疗器械 第 1 部分:风险管理应用推荐性修订YY/T 0771.1-2009 本标准规定了识别与采用动物源性材料(无活力或使其成为无活力)制造的医疗器械相关的危险(源)与危险情况、对所产生的风险的估计、评价和控制,以及监督这些控制有效性的程序(与YY/T 0316-2016结合)。本标准适用于采用动物源性材料(无活力或使其成为无活力)制造的医疗器械,不包括体外诊断医疗器械。本标准不适用于使用人体组织的医疗器械。本标准未规定医疗器械整个生产阶段控制的质量管理体系。此外,在考虑到YY/T 0316-2016 中所定义的剩余风险以及权衡与其他替代品进行比较的预期医疗受益,本标准给出了剩余风险可接受性的判断过程,以及对采用动物组织或其衍生物制造的医疗器械有关危险(源)的风险管理的要求和指南,这些危险(源)包括:细菌、霉菌或酵母菌污染;病毒污染;传播性海绵状脑病(TSE)因子污染;材料引起的非期望的致热性、免2021...