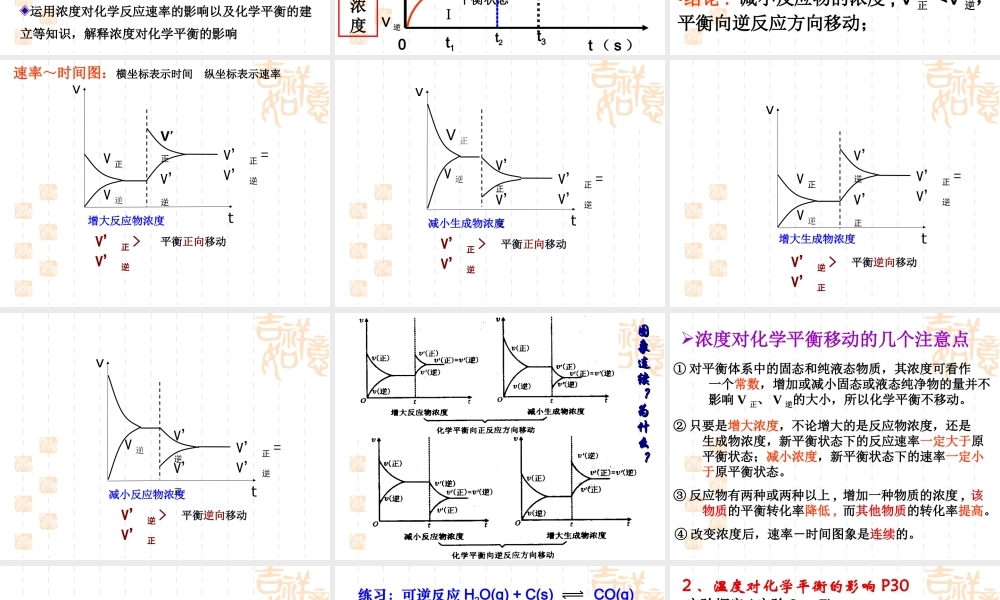
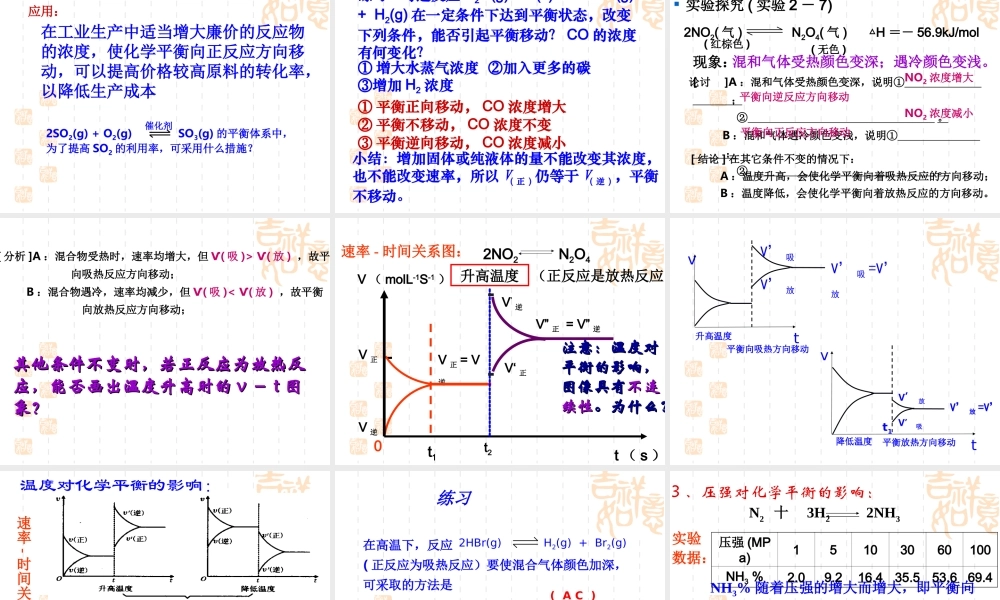
定义:可逆反应中,旧化学平衡被破坏,新化学平衡建立过程,叫做化学平衡的移动。V 正≠ V逆V 正 =V 逆≠ 0条件改变平衡 1 不平衡 平衡 2建立新平衡破坏旧平衡V 正 =V 逆≠ 0′′一定时间二、化学平衡的移动′′【思考与交流】有哪些条件能改变化学平衡呢? 1 、浓度对化学平衡的影响( P28 )溶液橙色加深溶液黄色加深 现象分析 : Cr2O72- + H2O 2CrO42-+2H+ 橙色 黄色滴加 3 ~ 10 滴浓 H2SO4滴加 10 ~ 20 滴 6mol/LNaOHK2Cr2O7 溶液增大 c(H+)橙色加深C(Cr2O72-) 增大平衡逆向移动平衡破坏减小 c(H+)黄色加深平衡破坏平衡正向移动结论 : 增大生成物的浓度平衡向逆反应方向移动结论 : 减小生成物的浓度平衡向正反应方向移动溶液黄色加深C(CrO42-) 增大溶液橙色加深 实验探究 (P29 实验 2 - 6)FeCl3+3KSCN Fe(SCN)3+3KCl现象:溶液变成红色( 血红色 )A. 加少量 FeCl3 的红色加深;B. 加少量 KSCN 的红色也加深;( 无色 )( 黄色 )( 无色 )思考——加少量 NaOH 溶液颜色有何变化。有红褐色沉淀生成,溶液红色变浅 实验结论:在其他条件不变时,增大反应物或减小生成物的浓度化学平衡向正反应方向移动减小反应物或增大生成物的浓度化学平衡向逆反应方向移动向右移动向左移动原因分析 :运用浓度对化学反应速率的影响以及化学平衡的建立等知识,解释浓度对化学平衡的影响 t2V” 正 = V” 逆V’逆V,正t3V 正 = V 逆V 正V 逆t1t ( s ) V ( molL-1S-1 )0 平衡状态Ⅰ平衡状态Ⅱ增大反应物浓度速率 - 时间关系图:原因分析 :•增加反应物的浓度 , V 正 > V 逆,平衡向正反应方向移动; 当减小反应物的浓度时 , 化学平衡将怎样移动 ?速率 - 时间关系图:•结论 : 减小反应物的浓度 , V 正 V’ 逆V’正平衡正向移动V’ 正 =V’ 逆速率~时间图:横坐标表示时间 纵坐标表示速率 减小生成物浓度vtV 逆V’ 正 =V’ 逆平衡正向移动V’ 正 >V’ 逆V’正V’逆V 正 增大生成物浓度V’逆vtV 正V 逆V’正V’ 正 =V’ 逆平衡逆向移动V’ 逆 >V’ 正 减小反应物浓度V’逆vtV 逆V’正V’ 正 =V’ 逆平衡逆向移动V’ 逆 >V’ 正 图象连续?为什么?图象连续?为什么? 浓度对化学平衡移动的几个注意点① 对平衡体系中的固...