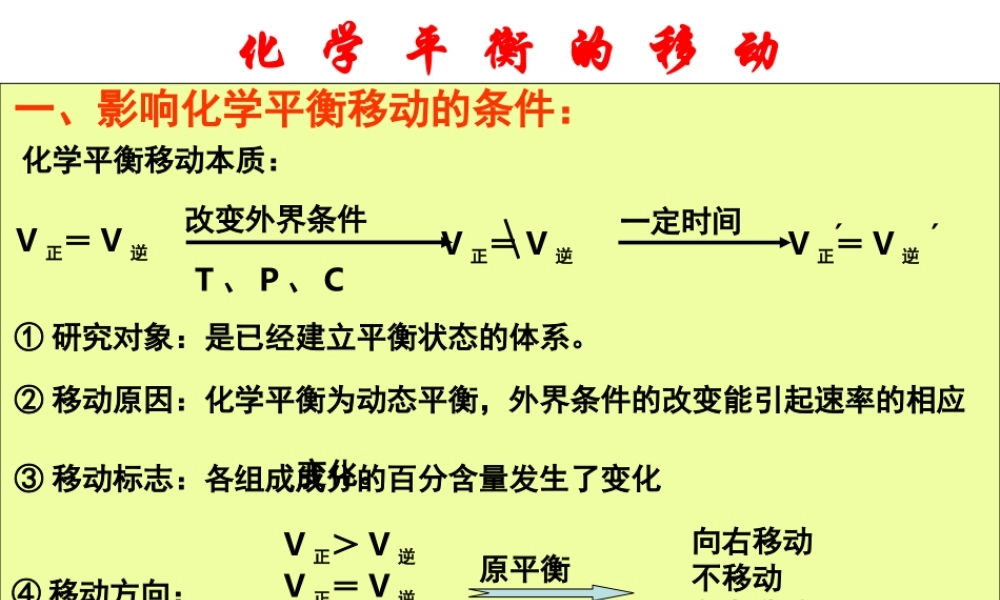
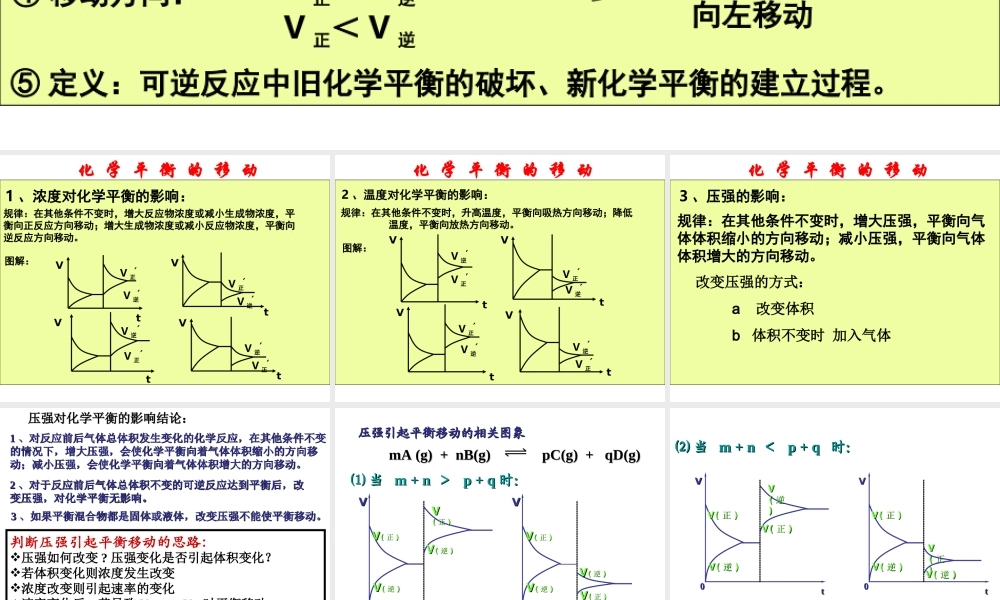
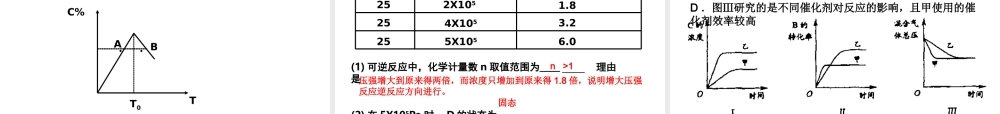
化 学 平 衡 的 移 动一、影响化学平衡移动的条件:化学平衡移动本质:V 正= V 逆改变外界条件T 、 P 、 CV 正= V 逆一定时间V 正= V 逆′′① 研究对象:是已经建立平衡状态的体系。② 移动原因:化学平衡为动态平衡,外界条件的改变能引起速率的相应 变化。③ 移动标志:各组成成分的百分含量发生了变化④ 移动方向:V 正> V 逆V 正= V 逆V 正< V 逆原平衡向右移动不移动向左移动⑤ 定义:可逆反应中旧化学平衡的破坏、新化学平衡的建立过程。 化 学 平 衡规律:在其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。图解:V 正′V 逆′VtV 逆′V 正′VtV 正′V 逆′VtV 逆′V 正′Vt1 、浓度对化学平衡的影响:化 学 平 衡 的 移 动 化 学 平 衡2 、温度对化学平衡的影响:规律:在其他条件不变时,升高温度,平衡向吸热方向移动;降低 温度,平衡向放热方向移动。V 正′V 逆′tVV 正′V 逆′VtV 正′V 逆′VtV 逆′V 正′Vt图解:化 学 平 衡 的 移 动 化 学 平 衡3 、压强的影响:规律:在其他条件不变时,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向移动。化 学 平 衡 的 移 动改变压强的方式: a 改变体积 b 体积不变时 加入气体 压强对化学平衡的影响结论:压强对化学平衡的影响结论:11 、对反应前后气体总体积发生变化的化学反应,在其他条件不变、对反应前后气体总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使化学平衡向着气体体积增大的方向移动。动;减小压强,会使化学平衡向着气体体积增大的方向移动。22 、对于反应前后气体总体积不变的可逆反应达到平衡后,改、对于反应前后气体总体积不变的可逆反应达到平衡后,改变压强,对化学平衡无影响。变压强,对化学平衡无影响。33 、如果平衡混合物都是固体或液体,改变压强不能使平衡移动。、如果平衡混合物都是固体或液体,改变压强不能使平衡移动。判断压强引起平衡移动的思路:压强如何改变 ? 压强变化是否引起体积变化?若体积变化则浓度发生改变浓度改变则引起速率的变化速率变化后,若导致 V 正 ≠ V 逆时...