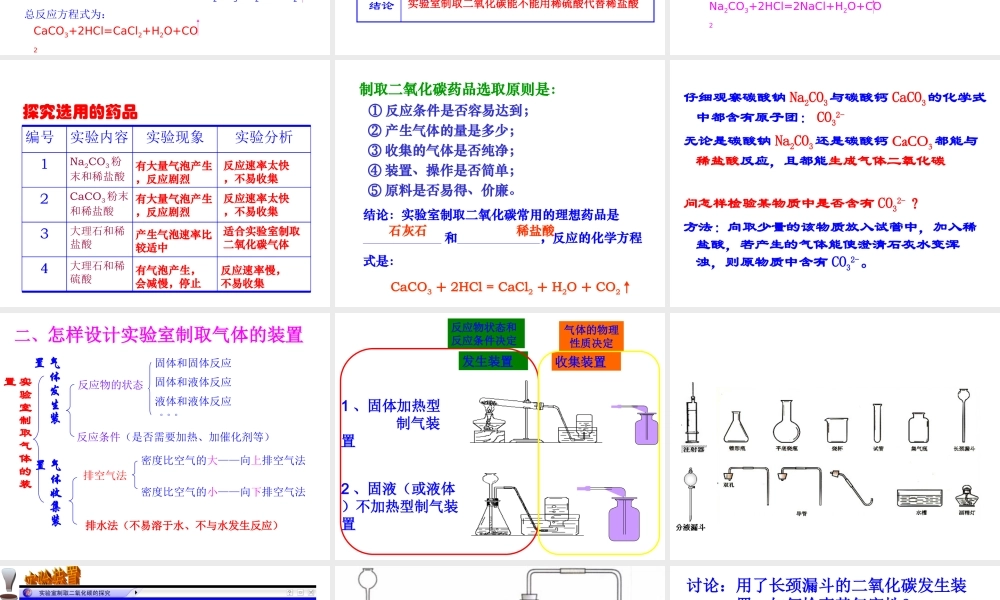
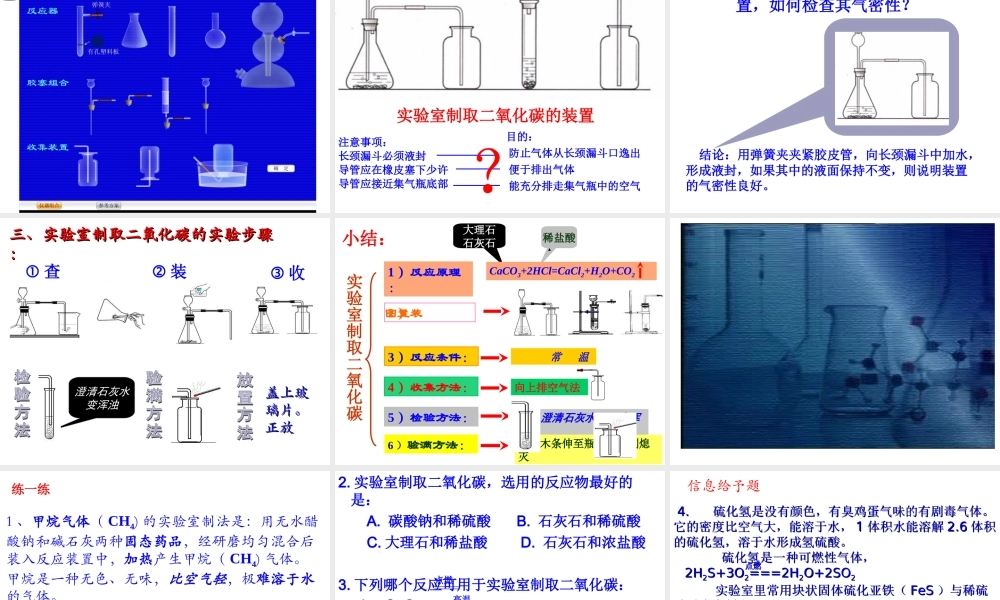
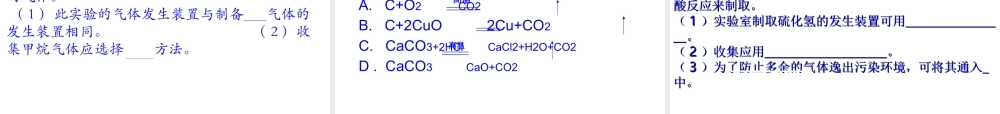
实验室制取氧气的知识回顾 反应原理 H2O2溶液和 MnO2验满方法 验证方法 收集装置 发生装置反应条件 反 应 物 状 态KMnO4 药品ABC 或 D 用带火星的木条伸进瓶内,木条复燃,则该气体是氧气。用带火星的木条放在瓶口,木条复燃,则氧气已满。固体、固体加热固体、液体不需要加热;催化剂2KMnO4 K2MnO4+MnO2+O2↑2KClO3===== 2KCl+3O2↑2H2O2 2H2O+O2↑==△MnO2MnO2 △ 二氧化碳的工业制法锻烧石灰石CaCO3===CaO+CO2↑高温11 、反应原理:、反应原理:一、反应原理一、反应原理及药品及药品::(5) N(5) Naa22COCO33 ++ 2HCl2HCl ==== 2N 2NaClaCl +H+H22OO ++ COCO22↑↑ (1) (1) CC ++ O O2 2 (充足) (充足) ==== COCO22↑↑ 点燃(2) (2) 22CCO O ++ O O2 2 ==== 2 2COCO22↑↑ 点燃(3) (3) CC ++ 2CuO 2CuO ==== 2Cu 2Cu + + COCO22↑↑ 高温(4) (4) CaCOCaCO33 ==== CaCaO O ++ COCO22↑↑ 高温(7) (7) CaCOCaCO33 ++ 2HCl2HCl ==== CaClCaCl22 +H+H22OO ++ COCO22↑↑ (8) (8) CaCOCaCO33++ H H22SOSO44==== CaCaSOSO44+H+H22OO ++ COCO22↑↑ ???2 、药品: 碳酸钠固体( NNaa22COCO33 )) 石灰石或大理石(主要成分是 CCaaCOCO33 )) 稀盐酸( HCl ) 稀硫酸( H2SO4 )(6) N(6) Naa22COCO33++ H H22SOSO44==== N Naa22SOSO44+H+H22OO ++ COCO22↑↑ 实验室制取二氧化碳的反应原理实验 1 :稀盐酸与大理石(或石灰石)反应现象分析有大量气泡产生,大理石逐渐溶解该反应在常温下进行,反应速度适中,便于控制。大理石与稀盐酸反应生成了碳酸和氯化钙:CaCO3+2HCl=CaCl2+H2CO3碳酸很不稳定,分解成水和二氧化碳:H2CO3=H2O+CO2总反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2实验 2 :稀硫酸与大理石(或石灰石)反应现象分析刚开始有大量气泡产生,一时间后,气泡逐渐减少 ,反应逐渐停止。虽然该反应能生成二氧化碳:CaCO3+H2SO4==CaSO4+H2O+CO2但生成的 CaSO4 微溶于水,覆盖在大理石表面,形成一层薄膜,使大理石与酸不能接触,反应难以进行。结论实验室制取二氧化碳能不能用稀硫酸代替稀盐酸实验 3 :稀盐酸与碳酸钠粉未反应现象分析结论反应非常剧烈,短时间产生大量气泡碳酸钠粉未的表面积很大,与盐酸接触面积大,反应速度很快,不易控制实验室不能用碳酸钠粉未或大理石粉未等粉未状物质制取二氧化碳...