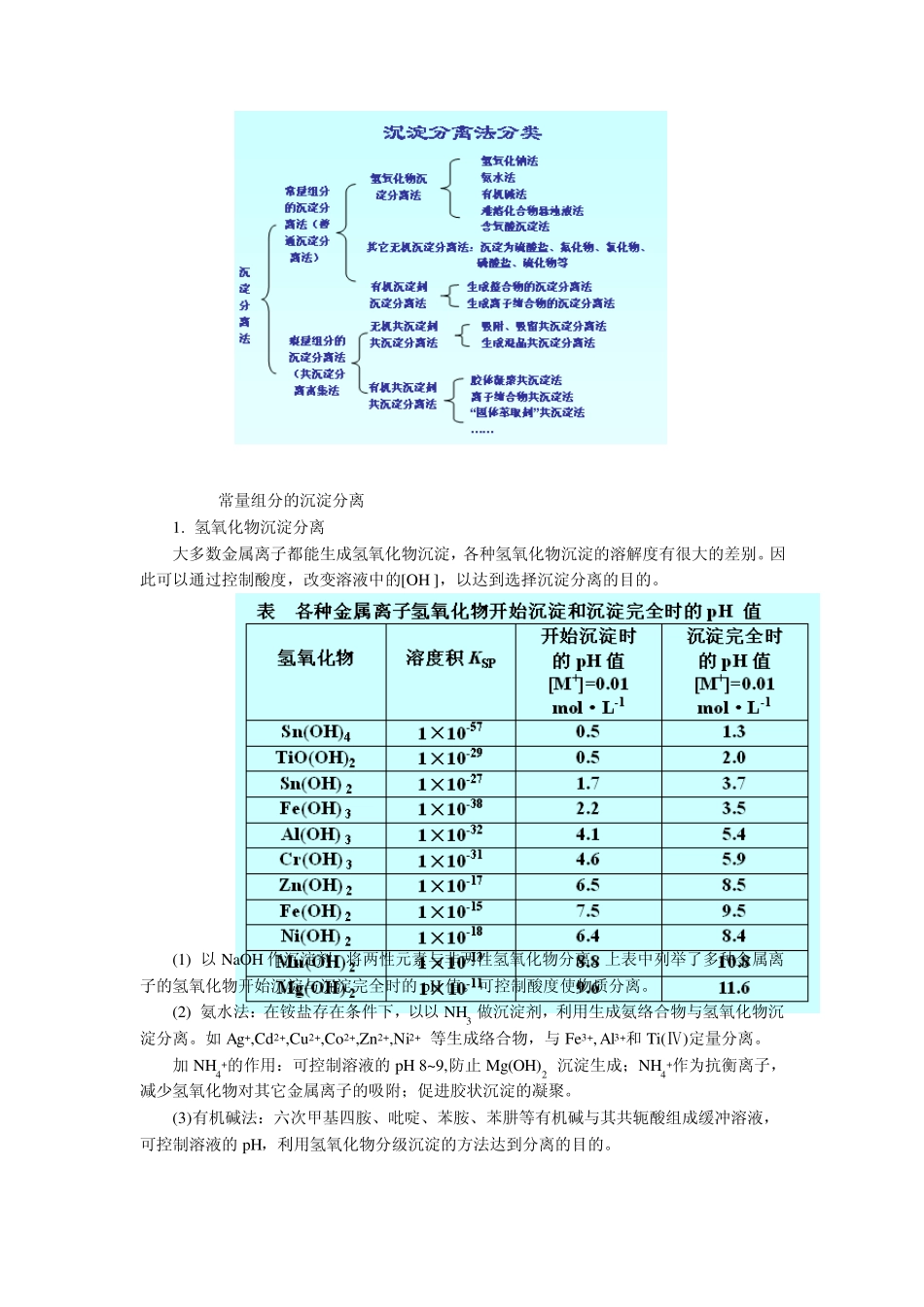
第8 章 分析化学中常用的分离和富集方法 8.1 概述 分离和富集是定量分析化学的重要组成部分。当分析对象中的共存物质对测定有干扰时,如果采用控制反应条件、掩蔽等方法仍不能消除其干扰时,就要将其分离,然后测定;当待测组分含量低、测定方法灵敏度不足够高时,就要先将微量待测组分富集,然后测定。分离过程往往也是富集过程。 对分离的要求是分离必须完全,即干扰组分减少到不再干扰的程度;而被测组分在分离过程中的损失要小至可忽略不计的程度。被测组分在分离过程中的损失,可用回收率来衡量。 1. 回收率(R) 其定义为:%100分离前待测组分的质量分离后待测组分的质量R 对质量分数为 1%以上的待测组分,一般要求 R>99.9%;对质量分数为 0.01%~1%的待测组分,要求 R>99%;质量分数小于 0.01%的痕量组分要求 R 为 90%~95%。 例 1. 含有钴与镍离子的混合溶液中,钴与镍的质量均为 20.0mg,用离子交换法分离钴镍后,溶液中余下的钴为 0.20mg,而镍为 19.0mg,钴镍的回收率分别为多少? 解:%0.10.2020.0 %,0.950.200.19CoNiRR 2. 分离因子 SA/B 分离因子 SB/A 等于干扰组分B 的回收率与待测组分A 的回收率的比,可用来表示干扰组分B 与待测组分A 的分离程度。 %100/ABABRRS B 的回收率越低,A 的回收率越高,分离因子越小,则 A 与 B 之间的分离就越完全,干扰消除越彻底。 8.2 沉淀分离法 沉淀分离法是一种经典的分离方法,它是利用沉淀反应选择性地沉淀某些离子,而与可溶性的离子分离。沉淀分离法的主要依据是溶度积原理。 沉淀分离法的主要类型如下表。 8.2.1常量组分的沉淀分离 1. 氢氧化物沉淀分离 大多数金属离子都能生成氢氧化物沉淀,各种氢氧化物沉淀的溶解度有很大的差别。因此可以通过控制酸度,改变溶液中的[OH-],以达到选择沉淀分离的目的。 (1) 以NaOH 作沉淀剂,将两性元素与非两性氢氧化物分离。上表中列举了多种金属离子的氢氧化物开始沉淀与沉淀完全时的pH 值。可控制酸度使物质分离。 (2) 氨水法:在铵盐存在条件下,以以NH3 做沉淀剂,利用生成氨络合物与氢氧化物沉淀分离。如Ag+,Cd2+,Cu2+,Co2+,Zn2+,Ni2+ 等生成络合物,与Fe3+, Al3+和Ti(Ⅳ)定量分离。 加 NH4+的作用:可控制溶液的pH 8~9,防止 Mg(OH)2 沉淀生成;NH4+作为抗衡离子,减少氢氧化物对其它金属离子的吸附;促进胶状沉淀的凝聚。 (3)有机碱法:六次甲基四胺、吡啶...