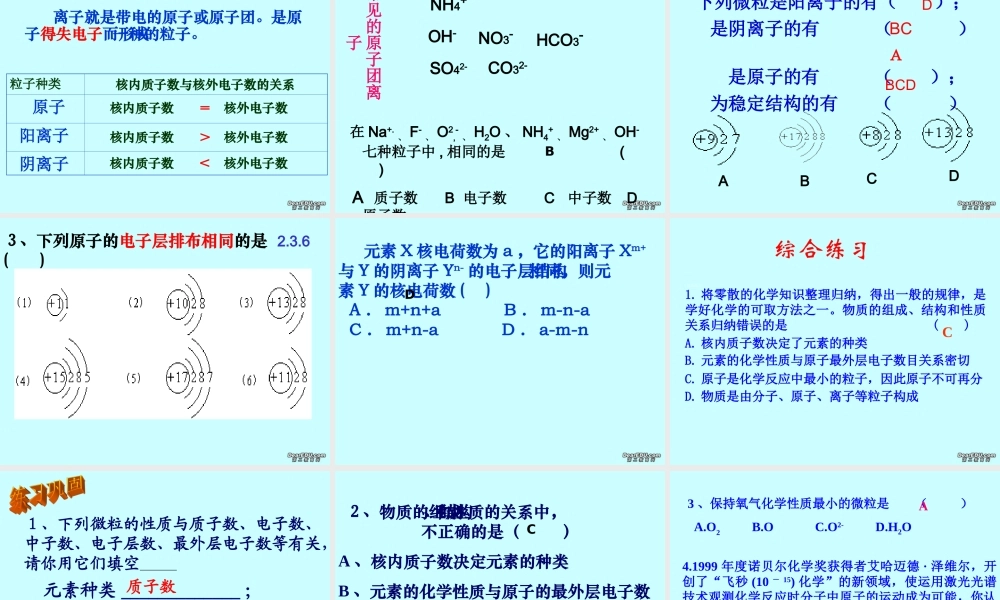
《物质构成的奥秘》单元复习复习目标1 、知道分子、原子、离子的区别。2 、能用微粒的观点解释某些常见的现象3 、知道原子是由原子核和核外电子构成的。4 、知道原子可以结合成分子、同一元素的 原子、离子可以相互转化。物质的构成物质分子构 成离子构 成原子构成构 成组 成元素总 称宏观概念微观概念(只讲种类 不讲个数)(既讲种类 又讲个数)分裂得失电子失得电子分子原子离子H2 、 O2 、N2H2O 、 CO2等金属:如 Fe稀有气体:如He金刚石( C )等NaCl 、 KCl 等我能构成哪些物质?表示方法:化学式表示方法:元素符号表示方法:离子符号什么是分子?分子就是一种保特物质化学性质的 最小粒子。 分子有哪些基本性质呢?1 、同种分子化学性质相同;2 、分子体积小,质量小;4 、分子在不停地运动;3 、分子之间有间隙;学习了微粒的性质,明明在家做了个实验,验证微粒的性质。将一个透明玻璃杯装上水,放入一大块冰糖,用细线记录下水位(如图所示)。过一段时间观察到的现象:( 1 ) ,说明 ;( 2 ) ,说明 。 冰糖消失 微粒不断运动液面下降 微粒间有空隙练一练2 、从分子的角度分析水的蒸发与水的分解两种变化的不同之处。 变化或现象 解释水的蒸发水的分解水分解时,水分子变成了氢分子和氧分子。水蒸发时,水分子本身没有变化,变化的只是分子间的间隔。讨论 ? 在化学变化中分子发生了变化,那么构成分子的原子是否也发生变化? 在化学变化中,发生变化的是分子,原子没有发生变化。原子是化学变化中的最小粒子原子核电子质子中子决定元素种类最外层电子数决定元素化学性质决定 原子质量( + )(-)( + )(不带电)核电荷数 = 质子数 = 电子数相对原子质量 = 质子数 + 中子数原子原子结构原子构成的规律: ⑴ 、原子核所带的电荷数简称为核电荷数⑵ 、核电荷数 = 质子数 = 核外电子数 ⑶ 、质 子 数 不 一 定 等 于 中 子 数 ⑷ 、原 子 中 不 一 定 含 有 中 子 ⑸ 、不种类的原子,其核内质子数和核外 电子数都不相同原 子 的 质 量 主 要 集 中 在 原 子 核 上 据中央电视台 6 月 3 日对云南抚仙湖湖底古城考古的现场报道,科学家曾通过测定古生物遗骸的碳14 含量来推断古城年代。碳 14 原子的核电荷数为 6 ,相对原子质量为 14 。下列关于碳 14 原子的说法中,错误的是( ) A 、中子数为 6 B...