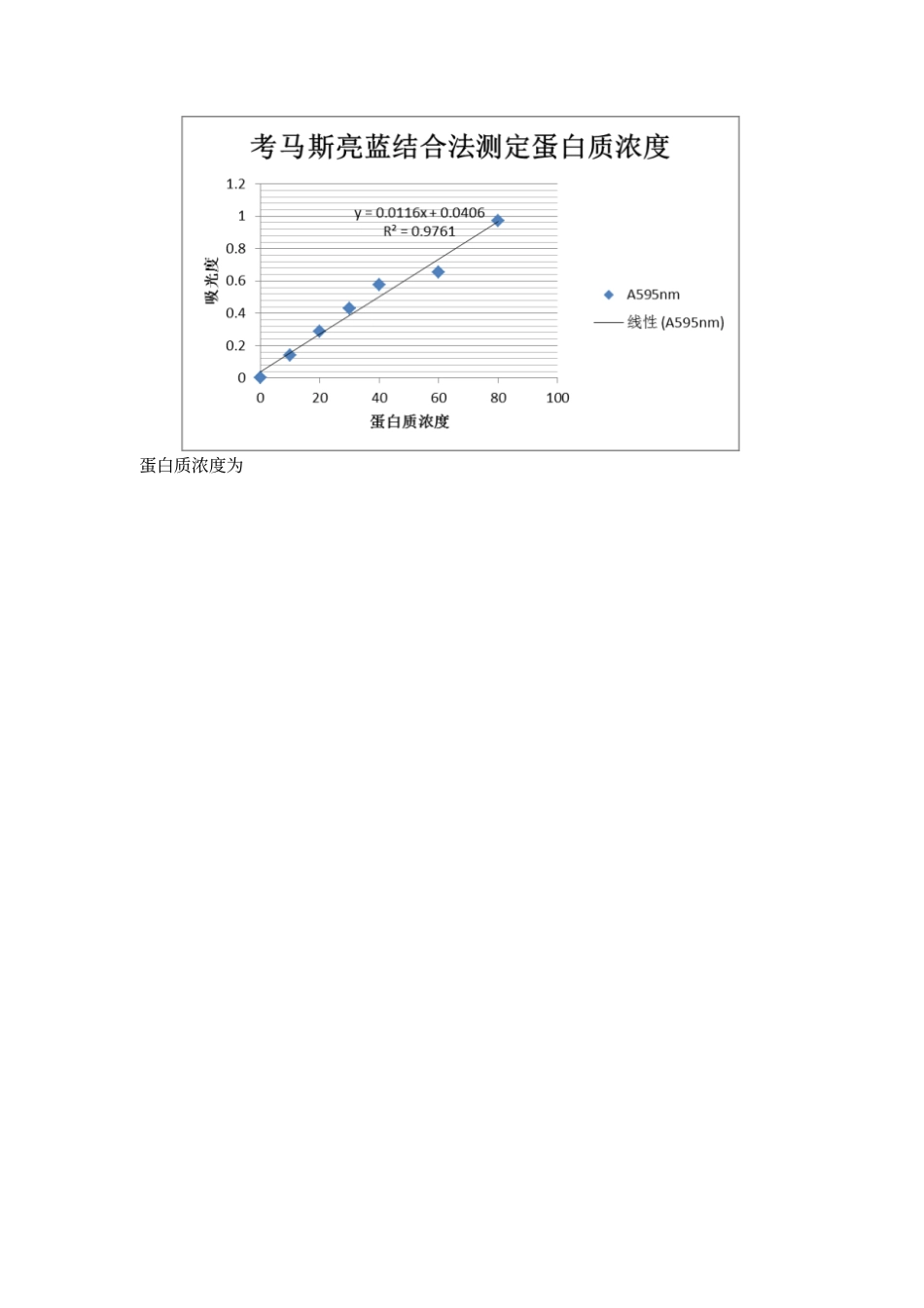
牛乳中酪蛋白的制备与浓度测定一、实验目的1、学习从牛乳中分离酪蛋白的原理和方法2、掌握等电点沉淀法提取蛋白质的方法3、了解紫外吸收法测定蛋白质浓度的原理,熟悉紫外分光光度计的使用4、学会用考马斯亮蓝结合法测定蛋白质浓度二、实验原理1、准备酪蛋白原理:牛乳中主要含有酪蛋白和乳清蛋白两种蛋白质,其中酪蛋白占了牛乳蛋白质的80%。牛乳在 PH4.7 时酪蛋白等电聚沉后剩余的蛋白质统称为乳清蛋白。酪蛋白是白色、无味的物质,不溶于水、乙醇等有机溶剂,但溶于碱溶液。乳清蛋白不同于酪蛋白,其粒子的水和能力很强,分散性高,在乳中呈高分子状态。 本法利用等电点时溶解度最低的原理,将牛乳的 PH 调至 4.7时,酪蛋白就沉淀出来。 用乙醇洗涤沉淀物, 除去脂类杂质后便可得到纯的酪蛋白。2、紫外吸收法测定蛋白质浓度的原理:大多数蛋白质由于有酷氨酸和色氨酸的存在,在紫外光280nm 有吸收高峰,可以进行蛋白质含量的测定。但是核酸在 280nm 也有吸收,干扰测定,不过核酸的最大吸收峰在260nm,通过测定在 280nm 和 260nm 时 A 的比值,然后通过计算消除核酸存在的影响,可以求得有核酸存在时蛋白质的浓度。3、考马斯亮蓝结合法测定蛋白质浓度原理:考马斯亮蓝能与蛋白质的疏水微区相结合,这种结合具有高敏感性。考马斯亮蓝G250 的磷酸溶液呈棕红色,最大吸收峰在 465nm。当它与蛋白质结合形成复合物时呈蓝色,其最大吸收峰改变为 595nm,考马斯亮蓝 G250—蛋白质复合物的高消光效应导致了蛋白质定量测定的高敏感度。在一定范围内,考马斯亮蓝G250—蛋白质复合物呈色后,在595nm 下,吸光度与蛋白质含量呈线性关系,故可以用于蛋白质浓度的测定。三、实验器材与试剂1、制备酪蛋白:烧杯、玻璃棒、量筒、精密PH 试纸、离心机、布氏漏斗、表面皿、恒温水浴锅牛奶、醋酸缓冲液、冰醋酸、95%乙醇、无水乙醚2、紫外光吸收法:紫外可见光分光光度计、容量瓶50ml(×1)、石英比色皿0.9%NaCl、1mol/LNaOH 溶液、 1mol/L 乙酸溶液3、考马斯亮蓝法:紫外可见光分光光度计、试管1.5cm×15cm(×9)、玻璃比色皿牛血清白蛋白( 0.1mg/ml)、考马斯亮蓝、 0.9%NaCl 四、实验步骤制备酪蛋白1、将 20mL pH4.7 的醋酸 -醋酸钠缓冲液预热至40℃2、将 20mL 牛奶加热至 40℃,在搅拌下缓慢地加入20mL 预热的 pH4.7 的醋酸 -醋酸钠缓冲液3、用精密 pH 试纸调 pH 至 4.7,可见溶液变为乳白色悬浮液4、待悬浮液冷却...