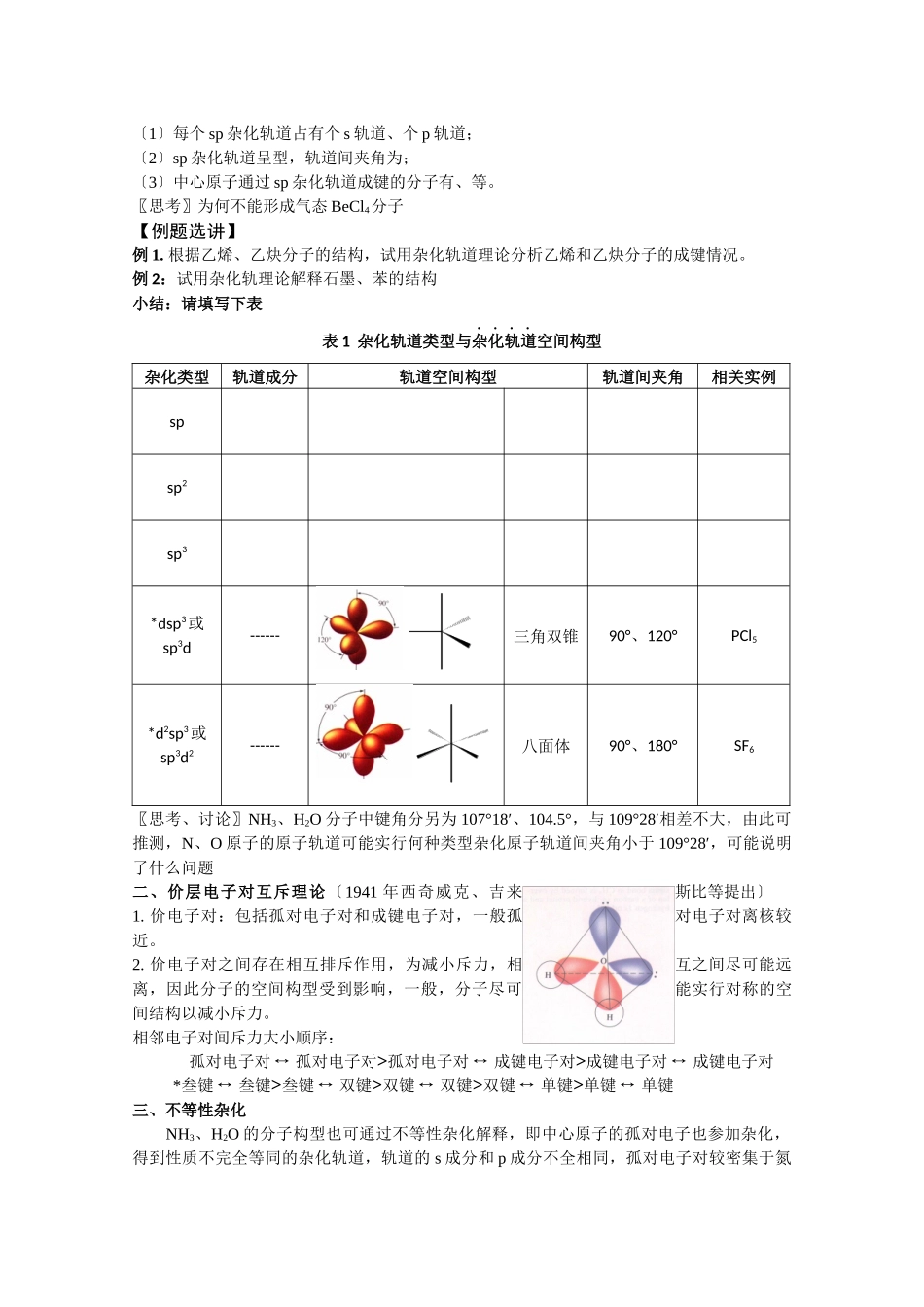
第一单元 分子构型与物质的性质第一课时 分子的空间构型 【学习目标】1.理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;2.学会用杂化轨道原理解释常见分子的成键情况与空间构型;3.掌握价层电子对互斥理论,知道确定分子空间构型的简易方法;4.了解等电子原理及其应用。【学习重点】杂化轨道理论、价层电子对互斥理论、分子空间构型的简易方法、等电子原理【学习难点】杂化轨道理论、价层电子对互斥理论【学习方法】讲解法、归纳法【教学过程】〖你知道吗〗1.O 原子与 H 原子结合形成的分子为什么是 H2O,而不是 H3O 或 H4O2.C 原子与 H 原子结合形成的分子为什么是 CH4,而不是 CH2CH4分子为什么具有正四面体结构3.为什么 H2O 分子是“V〞型.键角是 104.5°,而不是“直线型〞或键角是“90°〞一、杂化轨道理论〔1931 年,美国化学家鲍林 L.Pauling 提出〕1. CH4 —— sp3杂化轨道排布式:电子云示意图:〔1〕能量相近的原子轨道才能参加杂化;〔2〕杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成 σ 键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定,所以 C 原子与 H 原子结合成稳定的 CH4,而不是 CH2。〔3〕杂化轨道能量相同,成分相同,如:每个 sp3杂化轨道占有个 s 轨道、个 p 轨道;〔4〕杂化轨道总数等参加杂化的原子轨道数目之和,如个 s 轨道和个 p 轨道杂化成个 sp3杂化轨道〔5〕正四面体结构的分子或离子的中心原子,一般实行 sp3 杂化轨道形式形成化学键,如CCl4、NH4+等,原子晶体金刚石、晶体硅、SiO2等中 C 和 Si 也实行 sp3杂化形式,轨道间夹角为。2. BF3 —— sp2杂化型用轨道排布式表示 B 原子实行 sp2杂化轨道成键的形成过程:电子云示意图:〔1〕每个 sp2杂化轨道占有个 s 轨道、个 p 轨道;〔2〕sp2杂化轨道呈型,轨道间夹角为;〔3〕中心原子通过 sp2杂化轨道成键的分子有、等。〖思考、讨论〗根据现代价键理论即“电子配对理论〞,Be 原子外围电子排布式为 2s2,电子已配对不能形成共价键,但气态 BeCl2分子却能稳定存在,为什么3. 气态 BeCl2—— sp 杂化型用轨道排布式表示 Be 原子实行 sp 杂化轨道成键的形成过程:电子云示意图:〔1〕每个 sp 杂化轨道占有个 s 轨道、个 p 轨道;〔2〕sp 杂化轨道呈型,轨道间夹角为;〔3〕中心原子通过 sp ...