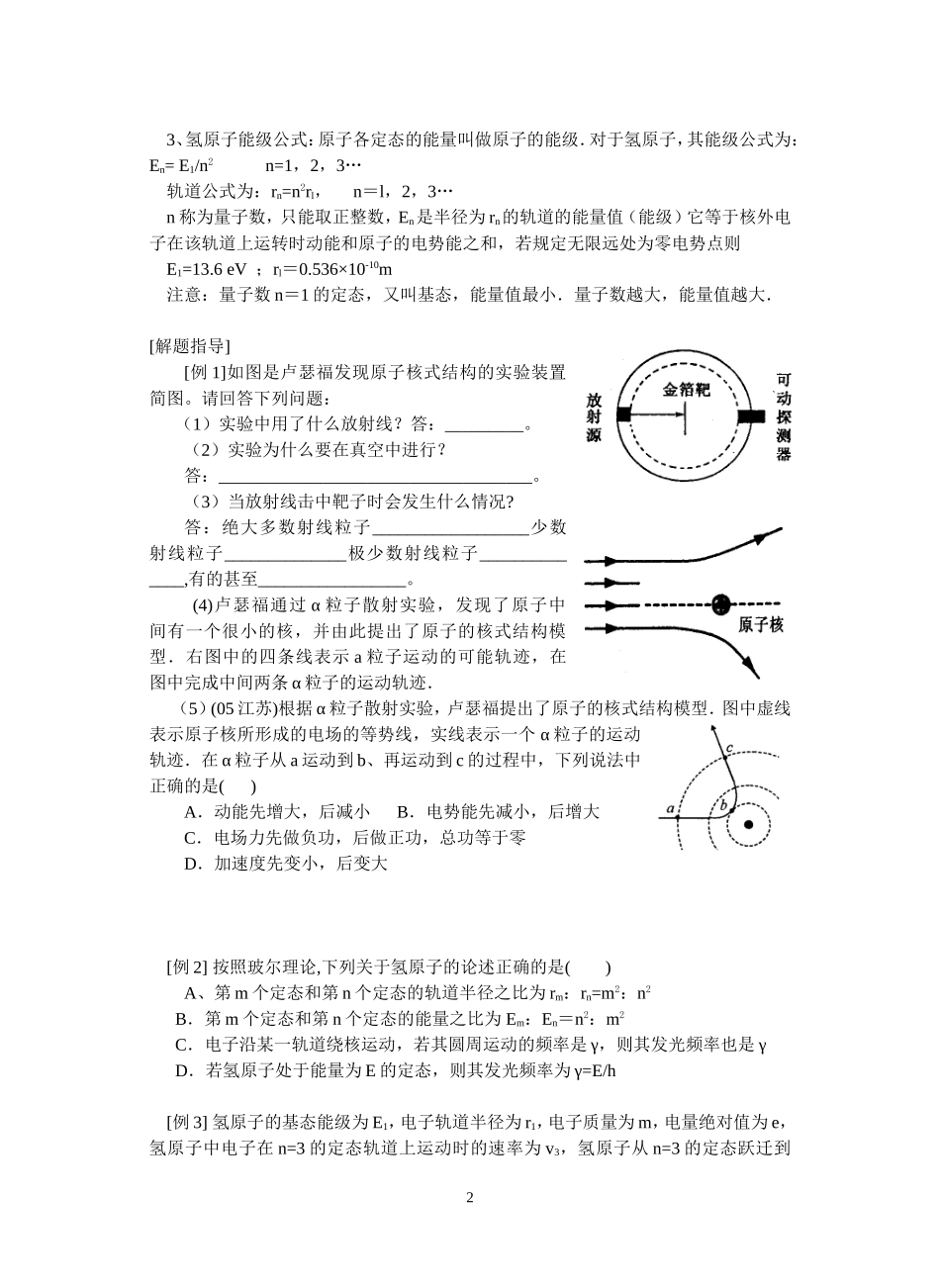
06 届高三物理一轮授课提纲十六、原子和原子核(1)[课 题] 原子结构模型[教学目标] 1、了解人们对原子结构的认识过程 2、掌握 α 粒子散射实验和原子核式结构的内容 3、理解玻尔模型的三条假设[教学重点] α 粒子散射实验和原子核式结构模型[教学难点] 玻尔模型的三条假设[知识要点]一、人们认识原子结构的思维线索. 气体放电的研究→阴极射线→发现电子(1897 年,汤姆生)→汤姆生的“枣糕模型”卢瑟福的核式结构模型玻尔模型(轨道量子化模型). 二、卢瑟福的核式结构模型1、α 粒子散射实验 做法:用质量是电子 7300 倍的 a 粒子轰击薄金箔. 结果:绝大多数 α 粒子穿过金箔后直进,少数 α 粒子发生了较大的偏转,极少数 α 粒子偏转角度超过 90°,有的甚至被弹回. 2、原子的核式结构 在原子的中心有一个很小的核,叫做原子核,原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间里绕着核旋转.原子核所带的正电荷数等于核外的电子数,所以整个原子是中性的。电子绕核运动的向心力就是核对它的库仑力. 3、实验数据估算:原子核大小的数量级为 10-15-10-14m,原子大小的数量级为 10-10 m.三、玻尔的轨道量子化模型 1、卢瑟福核式结构与经典电磁理论的矛盾:(1)原子是稳定的;(2)原子光谱是线状谱 2、玻尔的轨道量子化模型: 三条假设:①定态假设——原子只能处于一系列不连续的能量状态中,在这些状态中原子是稳定的,电子虽然做加速运动,但不向外辐射能量. ② 跃迁假设——原子从一种定态(设它的能量为 E 初)跃迁到另一种定态(设能量为E 末)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即 hγ=E 初一 E 末 ③ 轨道量子化假设——原子的不同能量状态跟电子沿不同的圆形轨道绕核运动相对应.原子的定态是不连续的,因此电子的可能轨道的分布也是不连续的.1 3、氢原子能级公式:原子各定态的能量叫做原子的能级.对于氢原子,其能级公式为:En= E1/n2 n=1,2,3… 轨道公式为:rn=n2rl, n=l,2,3… n 称为量子数,只能取正整数,En是半径为 rn的轨道的能量值(能级)它等于核外电子在该轨道上运转时动能和原子的电势能之和,若规定无限远处为零电势点则 E1=13.6 eV ;rl=0.536×10-10m 注意:量子数 n=1 的定态,又叫基态,能量值最小.量子数越大,能量值越大. [解题指导][例 1]如图是卢瑟福发...