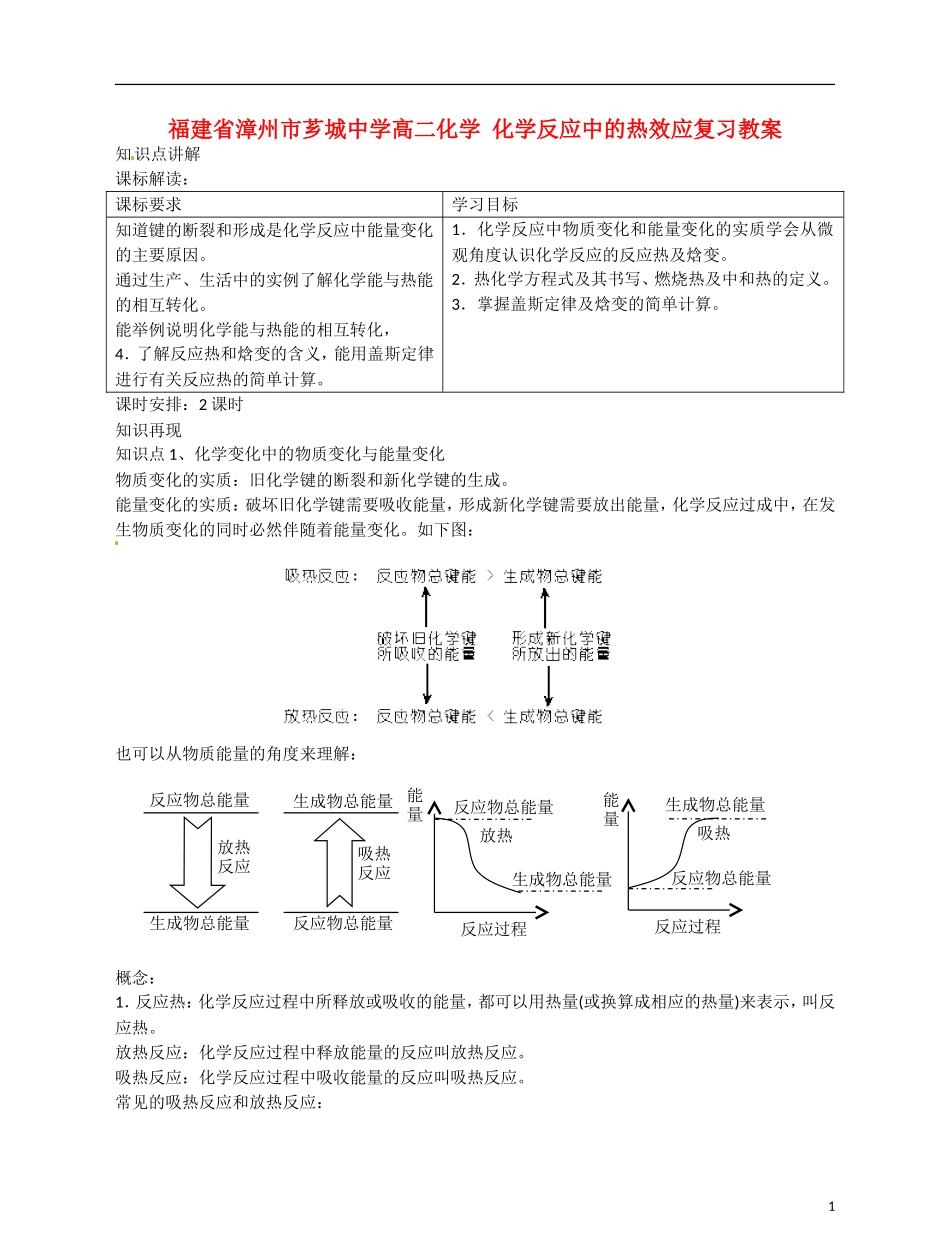
福建省漳州市芗城中学高二化学 化学反应中的热效应复习教案知识点讲解课标解读:课标要求学习目标知道键的断裂和形成是化学反应中能量变化的主要原因。通过生产、生活中的实例了解化学能与热能的相互转化。能举例说明化学能与热能的相互转化,4.了解反应热和焓变的含义,能用盖斯定律进行有关反应热的简单计算。1.化学反应中物质变化和能量变化的实质学会从微观角度认识化学反应的反应热及焓变。2.热化学方程式及其书写、燃烧热及中和热的定义。3.掌握盖斯定律及焓变的简单计算。课时安排:2 课时知识再现知识点 1、化学变化中的物质变化与能量变化物质变化的实质:旧化学键的断裂和新化学键的生成。能量变化的实质:破坏旧化学键需要吸收能量,形成新化学键需要放出能量,化学反应过成中,在发生物质变化的同时必然伴随着能量变化。如下图:也可以从物质能量的角度来理解:概念:1.反应热:化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表示,叫反应热。放热反应:化学反应过程中释放能量的反应叫放热反应。吸热反应:化学反应过程中吸收能量的反应叫吸热反应。常见的吸热反应和放热反应:1反应物总能量反应物总能量反应物总能量生成物总能量生成物总能量生成物总能量放热反应吸热反应反应过程放热反应物总能量生成物总能量反应过程吸热能量能量吸热反应:其特征是大多数反应过程需要持续加热,如C aCO3 分解等大多数分解反应,H2 和 I2、S、P等不活泼的非金属化合, B a(OH)2·8H2O 和 NH4Cl 固体反应,CO2 和 C 的反应。放热反应:燃烧、中和、金属和酸的反应、铝热反应等。说明:吸热反应有的不需要加热如:B a(OH)2·8H2O 和 NH4Cl 固体反应,多数需要加热,放热反应有的开始时需要加热以使反应启动。即反应的吸、放热与反应条件无关。4.燃烧热:25°C、101kPa 时,1mol 纯物质完全燃烧生成稳定的化合物时所放出的热量叫做该物质的燃烧热。单位:kJ/mol 或 J/mol。提示:(1)规定要在 25°C,101kPa 下测出热量,因为温度、压强不定反应热的数值也不相同。 (2)规定可燃物的物质的量为 1mol。(3)规定可燃物完全燃烧生成稳定的化合物所放出的热量为标准。所谓完全燃烧,是指物质中下列元素完全转化成对应的物质:C→CO2 ,H→H2O ,S→SO2 等。5.中和热:在稀溶液中,酸和碱发生反应时生成 1molH2O,这时的反应热叫做中和热。提示:(1)必须是酸和碱的稀溶液,因为...