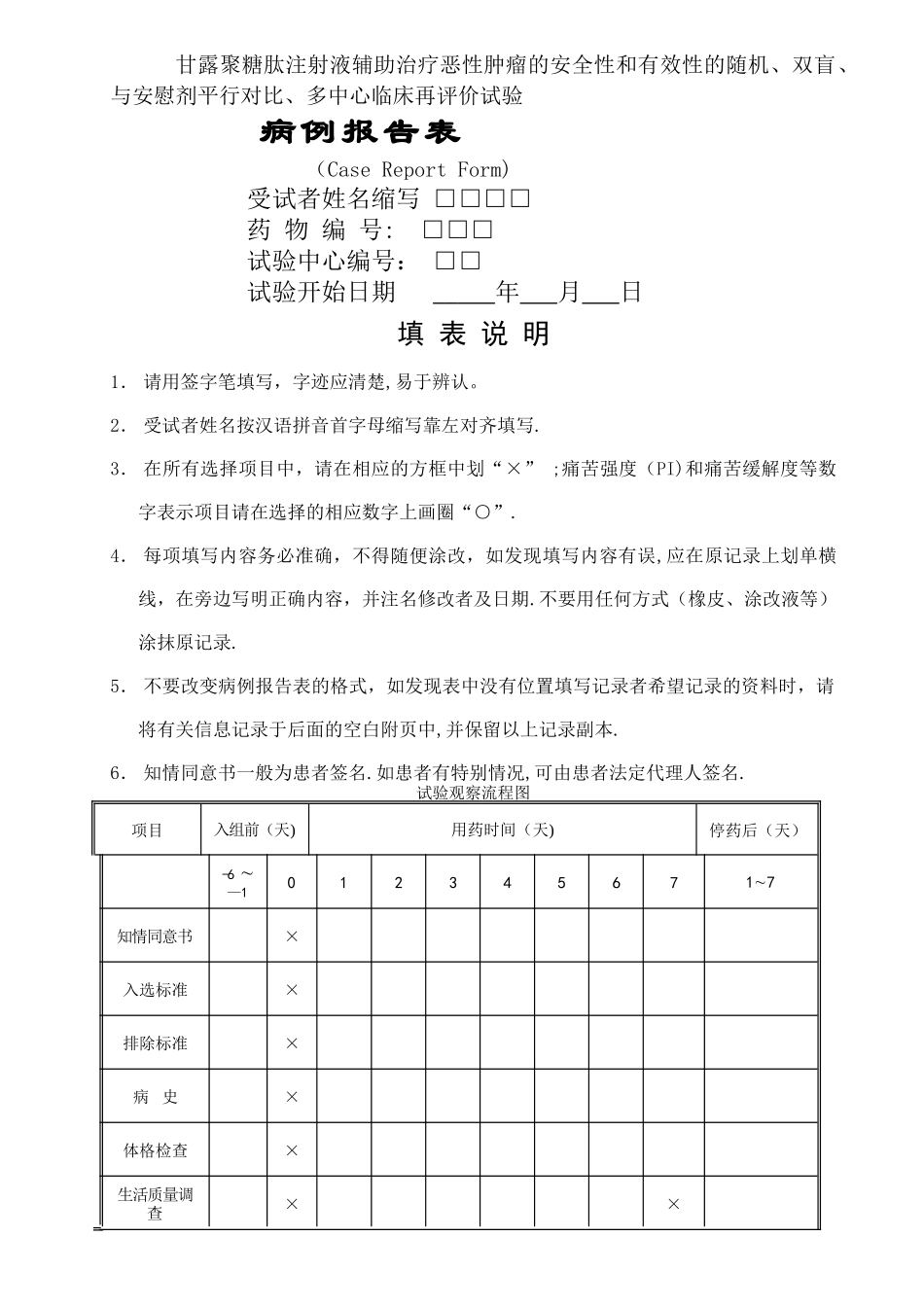
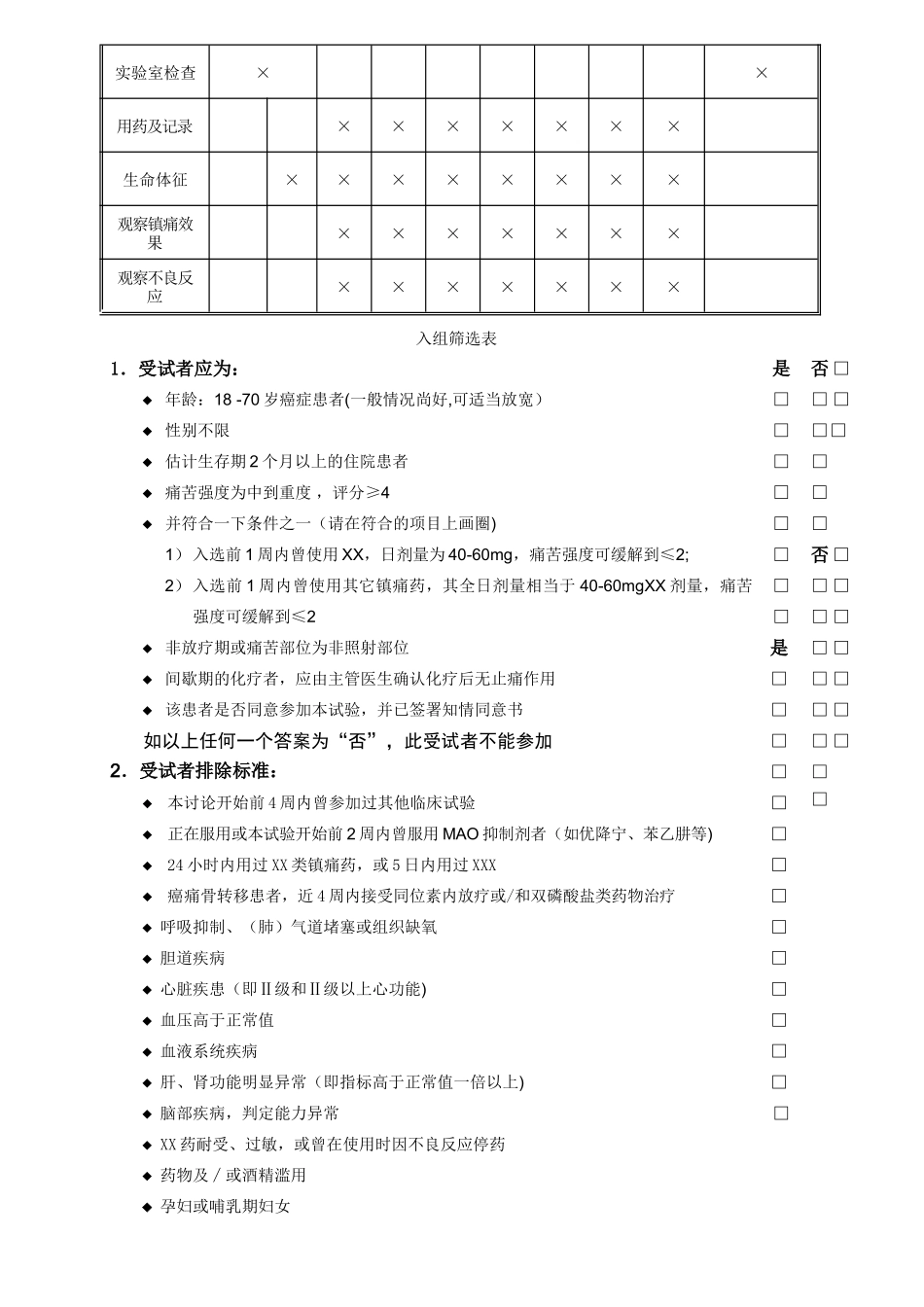
甘露聚糖肽注射液辅助治疗恶性肿瘤的安全性和有效性的随机、双盲、与安慰剂平行对比、多中心临床再评价试验病例报告表(Case Report Form) 受试者姓名缩写 □□□□ 药 物 编 号: □□□ 试验中心编号: □□ 试验开始日期 年 月 日填 表 说 明1. 请用签字笔填写,字迹应清楚,易于辨认。2. 受试者姓名按汉语拼音首字母缩写靠左对齐填写.3. 在所有选择项目中,请在相应的方框中划“×” ;痛苦强度(PI)和痛苦缓解度等数字表示项目请在选择的相应数字上画圈“○”.4. 每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期.不要用任何方式(橡皮、涂改液等)涂抹原记录.5. 不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本.6. 知情同意书一般为患者签名.如患者有特别情况,可由患者法定代理人签名.试验观察流程图项目入组前(天)用药时间(天)停药后(天)-6 —101234567 17知情同意书×入选标准×排除标准×病 史×体格检查×生活质量调查××实验室检查××用药及记录×××××××生命体征××××××××观察镇痛效果×××××××观察不良反应×××××××入组筛选表1.受试者应为: 年龄:18 -70 岁癌症患者(一般情况尚好,可适当放宽) 性别不限 估计生存期 2 个月以上的住院患者 痛苦强度为中到重度 ,评分≥4 并符合一下条件之一(请在符合的项目上画圈)1) 入选前 1 周内曾使用 XX,日剂量为 40-60mg,痛苦强度可缓解到≤2;2) 入选前 1 周内曾使用其它镇痛药,其全日剂量相当于 40-60mgXX 剂量,痛苦强度可缓解到≤2 非放疗期或痛苦部位为非照射部位 间歇期的化疗者,应由主管医生确认化疗后无止痛作用 该患者是否同意参加本试验,并已签署知情同意书如以上任何一个答案为“否”,此受试者不能参加2.受试者排除标准: 本讨论开始前 4 周内曾参加过其他临床试验 正在服用或本试验开始前 2 周内曾服用 MAO 抑制剂者(如优降宁、苯乙肼等)24 小时内用过 XX 类镇痛药,或 5 日内用过 XXX癌痛骨转移患者,近 4 周内接受同位素内放疗或/和双磷酸盐类药物治疗 呼吸抑制、(肺)气道堵塞或组织缺氧 胆道疾病 心脏疾患(即Ⅱ级和Ⅱ级以上心功能) 血压...