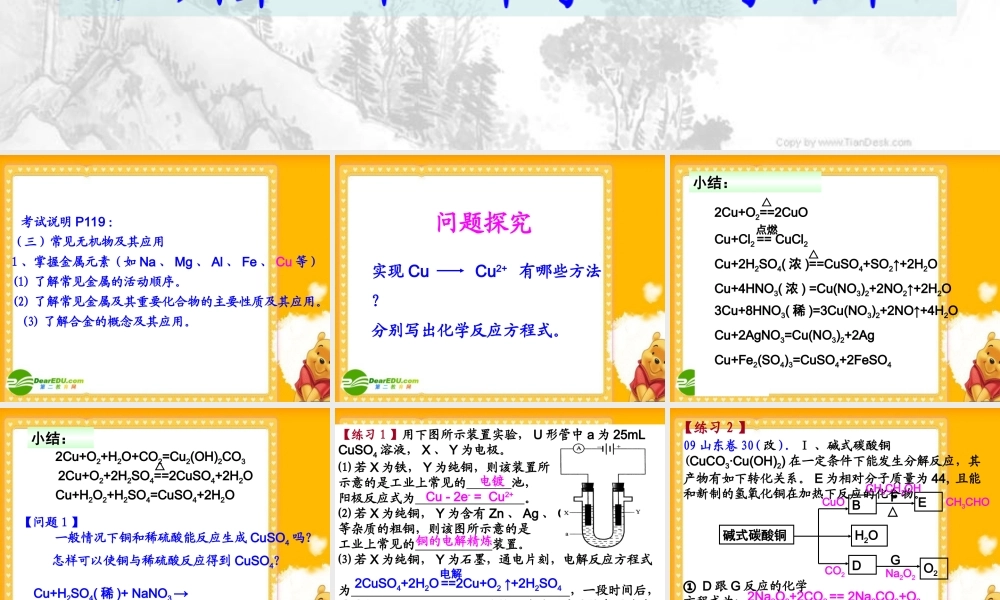
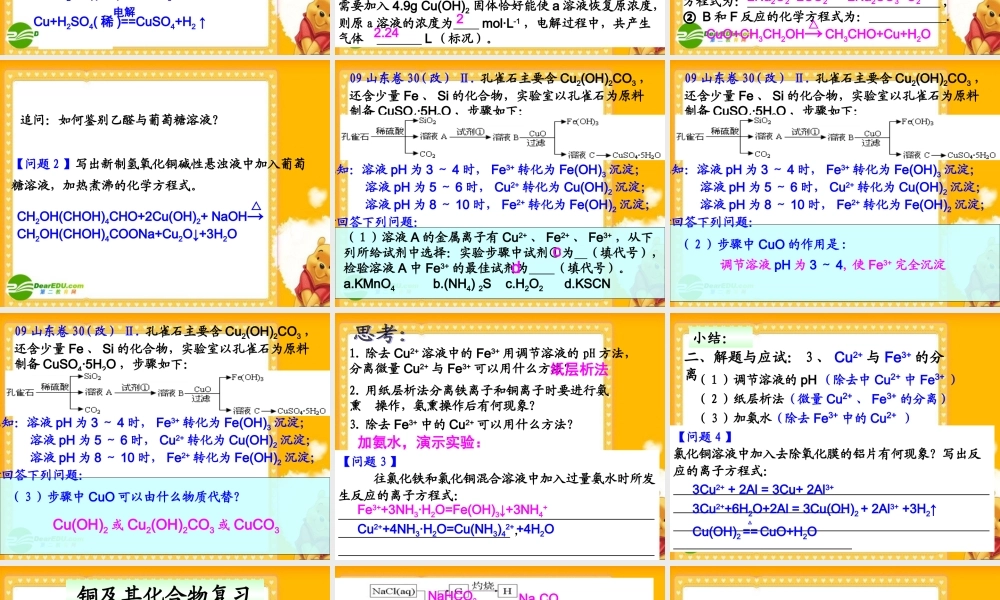
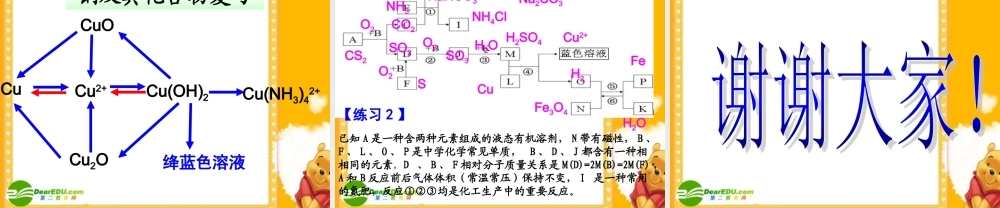
铜及其化合物解题与应试温州第二十二中学 季绍毕 考试说明 P119 :(三)常见无机物及其应用1 、掌握金属元素(如 Na 、 Mg 、 Al 、 Fe 、 Cu 等)(1) 了解常见金属的活动顺序。(2) 了解常见金属及其重要化合物的主要性质及其应用。 (3) 了解合金的概念及其应用。 问题探究实现 Cu Cu2+ 有哪些方法?分别写出化学反应方程式。 3Cu+8HNO3( 稀 )=3Cu(NO3)2+2NO↑+4H2O小结:Cu+4HNO3( 浓 ) =Cu(NO3)2+2NO2↑+2H2OCu+Fe2(SO4)3=CuSO4+2FeSO4Cu+2H2SO4( 浓 )==CuSO4+SO2↑+2H2O△Cu+Cl2 == CuCl2点燃2Cu+O2==2CuO△Cu+2AgNO3=Cu(NO3)2+2Ag 小结:Cu+H2O2+H2SO4=CuSO4+2H2O2Cu+O2+H2O+CO2=Cu2(OH)2CO32Cu+O2+2H2SO4==2CuSO4+2H2O△Cu+H2SO4( 稀 )==CuSO4+H2 ↑电解【问题 1 】 一般情况下铜和稀硫酸能反应生成 CuSO4 吗?怎样可以使铜与稀硫酸反应得到 CuSO4?Cu+H2SO4( 稀 )+ NaNO3 → 【练习 1 】用下图所示装置实验, U 形管中 a 为 25mL CuSO4 溶液, X 、 Y 为电极。⑴ 若 X 为铁, Y 为纯铜,则该装置所示意的是工业上常见的 池,阳极反应式为 。⑵ 若 X 为纯铜, Y 为含有 Zn 、 Ag 、 C等杂质的粗铜,则该图所示意的是工业上常见的 装置。⑶ 若 X 为纯铜, Y 为石墨,通电片刻,电解反应方程式为 ,一段时间后,需要加入 4.9g Cu(OH)2 固体恰好能使 a 溶液恢复原浓度,则原 a 溶液的浓度为 mol·L-1 ,电解过程中,共产生气体 L (标况)。 电镀 Cu - 2e- = Cu2+铜的电解精炼22.242CuSO4+2H2O ==2Cu+O2 ↑+2H2SO4电解 09 山东卷 30( 改 ). Ⅰ 、碱式碳酸铜(CuCO3·Cu(OH)2) 在一定条件下能发生分解反应,其产物有如下转化关系。 E 为相对分子质量为 44, 且能和新制的氢氧化铜在加热下反应的化合物。① D 跟 G 反应的化学方程式为: ,② B 和 F 反应的化学方程式为: .碱式碳酸铜BH2ODEO2FG△CuO+CH3CH2OH→ CH3CHO+Cu+H2O△2Na2O2+2CO2 == 2Na2CO3+O2【练习 2 】CO2Na2O2CuOCH3CH2OHCH3CHO 追问:如何鉴别乙醛与葡萄糖溶液?【问题 2 】写出新制氢氧化铜碱性悬浊液中加入葡萄糖溶液,加热煮沸的化学方程式。CH2OH(CHOH)4CHO+2Cu(OH)2+ NaOH→ CH2OH(CHOH)4COONa+Cu2O↓+3H2O△ ( 1 )溶液 A 的金属离子有 Cu2+ 、 Fe2+ 、 Fe3+ ,从下列所给试剂中选择:实验步骤中试剂①为 (填代号...