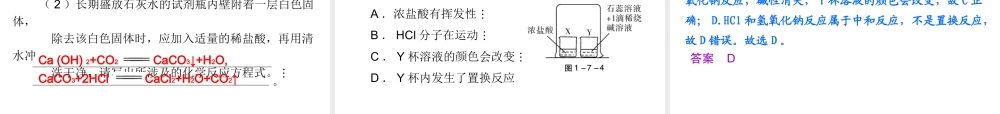
第七节 常见的碱 第一部分身边的化学物质要点 1 碱的组成与命名及溶解性 1. 酸碱定义: (1) 酸:由 离子和酸根离子形成的化合物;酸溶液中的阳离子只有 一种。 (2) 碱:由金属离子和 离子形成的化合物;碱溶液中的阴离子只有 一种。 2. 下列物质中属于酸的是 ;属于碱的是 ( 填字母 ) 。 A. NaOH B. C2H5OH C. CH3COOH( 醋酸 ) D. NH3·H2O氢氢氧根CADOH-H+ 3. 碱的命名规则:氢氧化某。如 NaOH 读作 4. 可溶于水的碱有: KOH 、 NaOH 、 Ca (OH) 2、Ba (OH) 2、 NH3·H2O ,其余的碱都不溶于水。 Cu (OH) 2是 色沉淀; Fe (OH) 3是 色沉淀; Mg (OH) 2是 色沉淀。 氢氧化钠蓝红褐白要点 2 氢氧化钠与氢氧化钙的物理性质 烧碱熟石灰腐蚀要点 3 CaCO3、 CaO 、 Ca (OH) 2之间的转化关系 1. 石灰石→生石灰→熟石灰→石灰水。 2. CaCO3、 CaO 、 Ca (OH) 2相互转化的化学方程式: (1) 高温煅烧石灰石: 。 (2) 生石灰与水反应得到熟石灰: CaO+H2O 。 (3) 石灰水中通入 CO2得到碳酸钙: 。 Ca (OH) 2CaCO3 CaO + CO2↑ CO2+ Ca (OH) 2 CaCO3↓ + H2O 要点 4 氢氧化钠与氢氧化钙的化学性质蓝色 红色 CaCO3↓+H2O Na2SO4+2H2O Fe (OH) 3↓+3NaCl Cu (OH) 2↓+Na2SO4 CaCO3↓+2NaOH 要点 5 中和反应及其在生产、生活中的应用 1. 和 作用生成 和 的反应叫做中和反应。中和反应的基本反应类型属于复分解反应。 2. 中和反应在实际生产和生活中有广泛的应用: (1) 如酸性土壤中通常是加入 ( 填名称 ) 来改良土壤。 (2) 处理工厂含有稀硫酸的废水也可用 来中和,反应原理用化学方程式表示为 。 (3) 中和胃酸可服用含有氢氧化镁的药物,反应的化学方程式为 。 (4) 被蚊虫叮咬处有蚁酸 (HCOOH) ,可以涂一些碱性物质 ( 如肥皂水 ) 减轻痛痒。 酸碱盐水熟石灰熟石灰 Ca (OH) 2+H2SO4 CaSO4+2H2OMg (OH) 2+2HCl MgCl2+2H2O要点 6 气体干燥 浓硫酸、 NaOH 固体都具有很好的吸水性,故都可作气体的干燥剂。但要注意,浓硫酸不可以干燥氨气(NH3) ,原因是硫酸与氨气可以发生反应生成铵盐[ (NH4) 2SO4],其化学反应方程式为 。 NaOH 固体在空气中容易吸收水分而潮解,因此氢氧化钠可作某些气体的干燥剂,如干燥H2、 O2、 CO 、 CH4、 NH3等;但不...