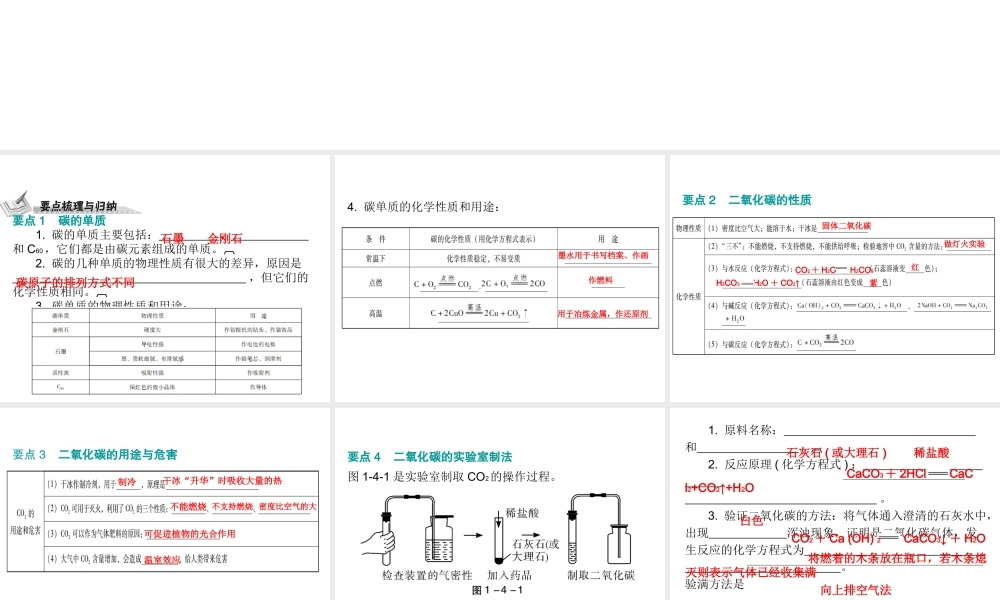
第四节 碳和碳的氧化物 第一部分身边的化学物质要点 1 碳的单质 1. 碳的单质主要包括: 、 和 C60,它们都是由碳元素组成的单质。 2. 碳的几种单质的物理性质有很大的差异,原因是 ,但它们的化学性质相同。 3. 碳单质的物理性质和用途: 石墨金刚石碳原子的排列方式不同4. 碳单质的化学性质和用途: 墨水用于书写档案、作画 作燃料 用于冶炼金属,作还原剂 要点 2 二氧化碳的性质 固体二氧化碳 做灯火实验 CO2+ H2O H2CO3 红H2CO3 H2O + CO2↑ 紫要点 3 二氧化碳的用途与危害 制冷 干冰“升华”时吸收大量的热 不能燃烧 不支持燃烧 密度比空气的大 可促进植物的光合作用 温室效应 要点 4 二氧化碳的实验室制法图 1-4-1 是实验室制取 CO2的操作过程。 1. 原料名称: 和 。 2. 反应原理 ( 化学方程式 ) : 。 3. 验证二氧化碳的方法:将气体通入澄清的石灰水中,出现 浑浊现象,证明是二氧化碳气体,发生反应的化学方程式为 。验满方法是 。 4. 收集 CO2的方法是 ,因为 CO2的密度 且 CO2 ,所以 CO2不能用排水法收集。 石灰石 ( 或大理石 )稀盐酸 CaCO3+ 2HCl CaCl2+CO2↑+H2O白色CO2+ Ca (OH) 2 CaCO3↓ + H2O 将燃着的木条放在瓶口,若木条熄灭则表示气体已经收集满向上排空气法比空气的大可溶于水要点 5 一氧化碳的性质和用途略小 难血红蛋白 缺氧 燃料 还原剂 要点 6 自然界中的碳循环 如图 1-4-2 是自然界中的碳循环示意图。 注意: (1)CO2不是空气污染物。 CO2会参与大气中的碳循环,是氧气的间接来源。由于 CO2的增多,会导致“温室效应”,但只是影响环境,并不会污染环境。 (2)CO2可以促进绿色植物的光合作用,因此在温室中可用作 。 气体肥料要点 7 几个需要注意的问题 1. 实验室中制取二氧化碳时,需要注意的问题: (1) 不用碳酸钠粉末代替石灰石与稀盐酸反应制取CO2的原因是:碳酸钠与盐酸反应速度太快,不便控制。 (2) 不用稀硫酸与石灰石反应制取 CO2的原因是:反应生成的 CaSO4微溶于水,会覆盖在碳酸钙表面阻止反应进一步进行。 (3) 不用浓盐酸与石灰石反应制取 CO2的原因是:浓盐酸有挥发性,会导致制得的 CO2气体不纯净。 2. 在实验室中,制取气体的装置包括发生装置和收集装置两部分。 确定气体发生装置时,应考虑反应物的状态和反应条件。 确定收集装置时,应考虑生...