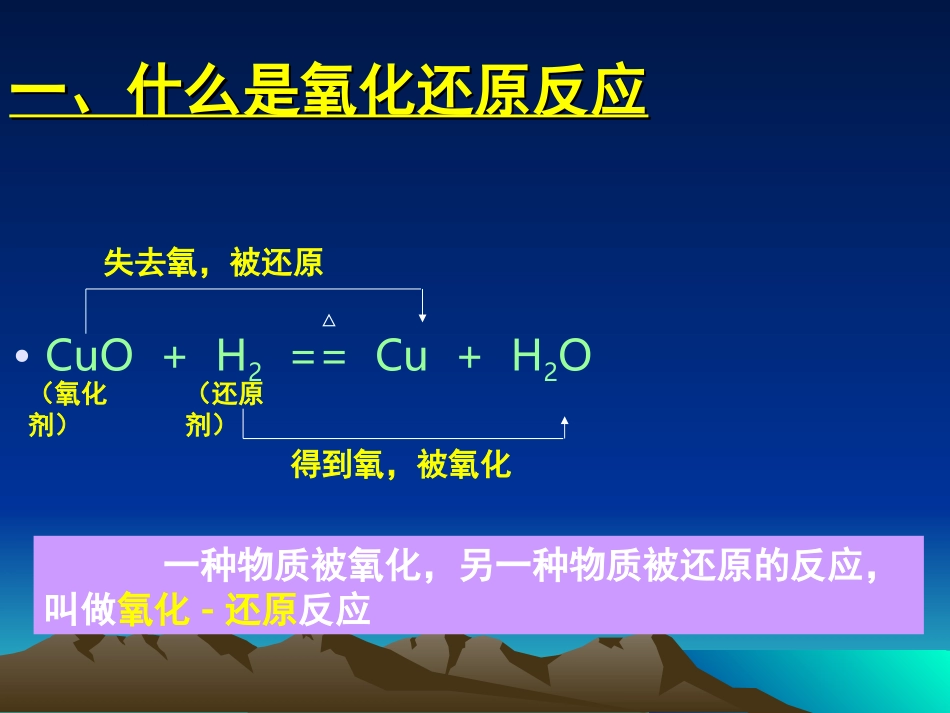
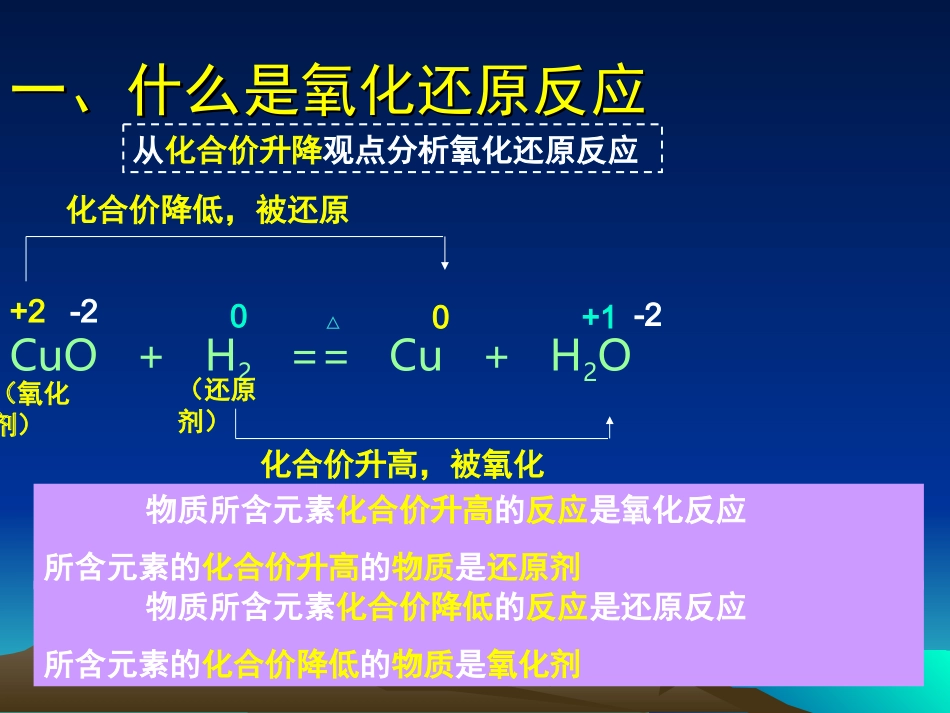
第三节氧化还原反应(一)第三节氧化还原反应(一)车胤中学高一化学组—刘震车胤中学高一化学组—刘震一、什么是氧化还原反应一、什么是氧化还原反应•CuO+H2==Cu+H2O△失去氧,被还原得到氧,被氧化(氧化剂)(还原剂)一种物质被氧化,另一种物质被还原的反应,叫做氧化-还原反应一、什么是氧化还原反应一、什么是氧化还原反应CuO+H2==Cu+H2O△+20-2-20+1化合价降低,被还原(氧化剂)(还原剂)化合价升高,被氧化物质所含元素化合价升高的反应是氧化反应所含元素的化合价升高的物质是还原剂物质所含元素化合价降低的反应是还原反应所含元素的化合价降低的物质是氧化剂从化合价升降观点分析氧化还原反应一、什么是氧化还原反应一、什么是氧化还原反应【练习】MnO2+4HCl(浓)==MnCl2+2H2O+Cl2↑从化合价升降观点分析氧化还原反应△+4-2+1-1+2-1+10-2化合价升高,被氧化化合价降低,被还原反应过程中凡是有元素化合价变化的化学反应,叫做氧化还原反应。一、什么是氧化还原反应一、什么是氧化还原反应2Na+Cl2==2NaCl元素化合价与电子得失的关系△00-1+1化合价升高,被氧化化合价降低,被还原NaNa+ClCl-Na+Cl-电子转移离子化合物:元素的化合价=该元素得失电子的数目化合价的升高数=失去电子的数目化合价的降低数=得到电子的数目得到电子的反应是还原反应失去电子的反应是氧化反应一、什么是氧化还原反应一、什么是氧化还原反应得到电子的反应物叫做氧化剂失去电子的反应物叫做还原剂凡是有电子转移(电子得失或者共用电子对偏移)的反应叫做氧化还原反应。2Na+Cl2==2NaCl△00-1+1失去2e-得到2e-从电子得失的观点分析氧化还原反应金属钠失去电子,是氯气得到电子,是还原剂氧化剂一、什么是氧化还原反应一、什么是氧化还原反应H2+Cl2==2HCl点燃一、什么是氧化还原反应一、什么是氧化还原反应•练习:分析化合价变化的情况,说明反应中的电子得失。•Mg+2HCl==MgCl2+2H2↑•镁元素的化合价由0升至+2失去2e-•(一个Mg失去2e-)•氢元素的化合价由+1降至0得到2e-•(一个H得到1e-,共有2个H共得到2e-)一、什么是氧化还原反应一、什么是氧化还原反应•1、得氧和失氧只是氧化还原反应的一部分•2、化合价发生改变是所有氧化还原反应的共同特征•3、电子得失是氧化还原反应的本质学会比较,总结分析失电子化合价升高被氧化还原剂(具有还原性)得电子化合价降低被还原氧化剂(具有氧化性)本质特征变化反应物(具有的性质)一、什么是氧化还原反应一、什么是氧化还原反应•记忆口诀:•失升氧,降得还,若说剂性正相反一、什么是氧化还原反应一、什么是氧化还原反应•氧化还原反应小结氧化剂+还原剂==还原产物+氧化产物得电子,被还原失电子,被氧化一、什么是氧化还原反应一、什么是氧化还原反应•氧化还原反应的分析方法:双线桥法CuO+H2==Cu+H2O△+20-2-20+1化合价降低,得1×2e-,被还原化合价升高,失2×e-,被氧化(氧化剂)(还原剂)一、什么是氧化还原反应一、什么是氧化还原反应•氧化还原反应的分析方法:单线桥法CuO+H2==Cu+H2O△+20-2-20+12e-(氧化剂)(还原剂)一、什么是氧化还原反应一、什么是氧化还原反应•练习:请分别用单线桥法、双线桥法分析下列反应CuO+CO==Cu+CO24NH3+3O2==2N2+6H2O高温点燃你的潜力,我的动力你的潜力,我的动力TheendTheend