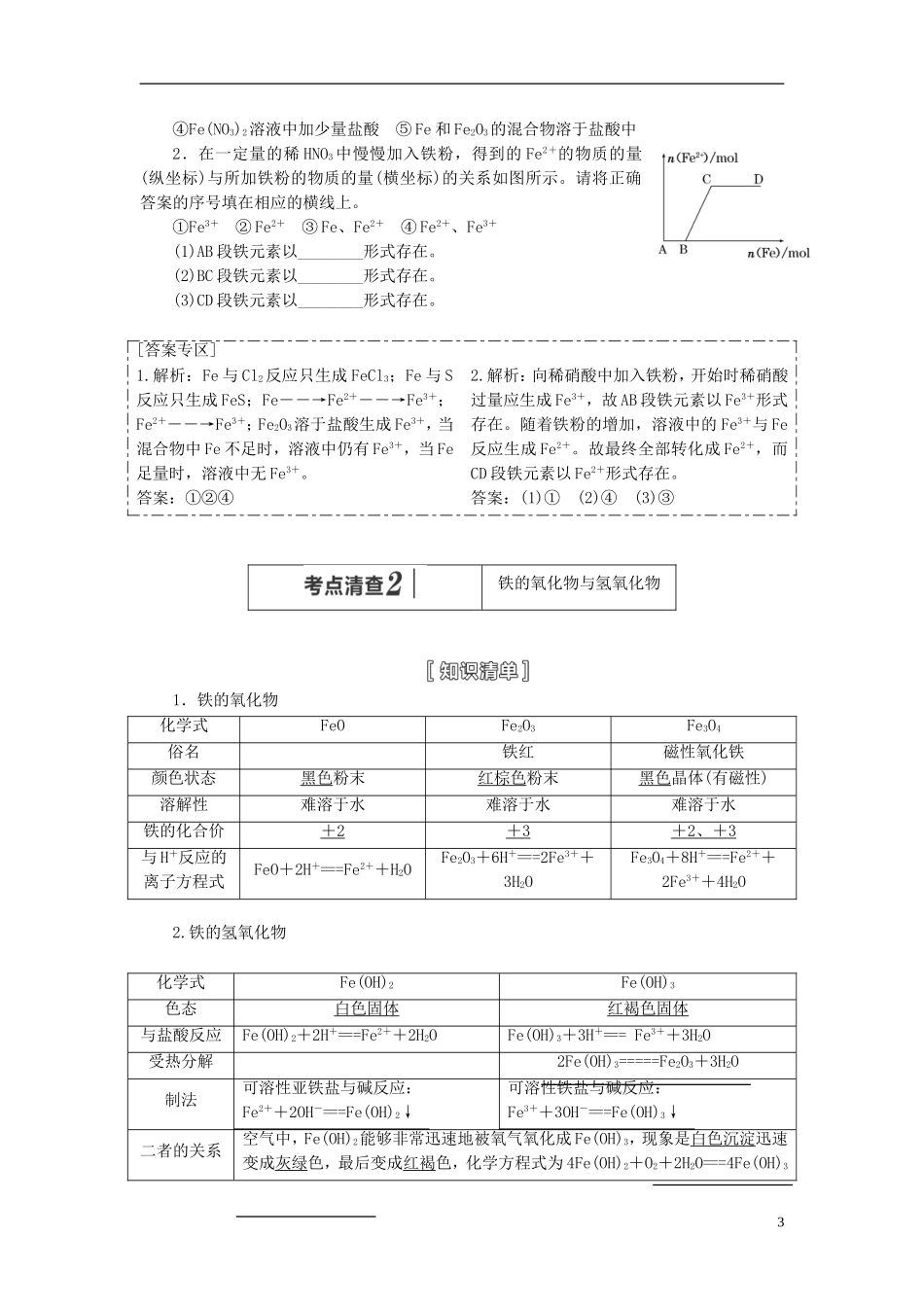
第三节铁及其化合物明考纲要求理主干脉络1.了解铁的主要性质及应用。2.了解铁的重要化合物的主要性质及应用。铁的性质及应用1.铁的物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。(1)与非金属单质的反应:①与O2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为Fe2O3。点燃时:3Fe+2O2=====Fe3O4。②与Cl2的反应:2Fe+3Cl2=====2FeCl3。③与S的反应:Fe+S=====FeS。(2)与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe+4H2O(g)=====Fe3O4+4H2。(3)与酸的反应:①与非氧化性酸反应的离子方程式:Fe+2H+===Fe2++H2↑。②与氧化性酸:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H2产生。(4)与某些盐溶液的反应:1①与CuSO4溶液反应的离子方程式:Fe+Cu2+===Fe2++Cu。②与FeCl3溶液反应的离子方程式:2Fe3++Fe===3Fe2+。1.判断下列描述的正误(正确的打“√”,错误的打“×”)。(1)(2013·新课标全国卷Ⅱ)浓盐酸与铁屑反应的离子方程式:2Fe+6H+===2Fe3++3H2↑。()(2)(2011·重庆高考)Fe分别与氯气和盐酸反应所得氯化物相同。()(3)(2012·山东高考)Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应。()(4)(2012·天津高考)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2。()(5)(2012·重庆高考)铁与硫混合共热生成FeS2。()(6)铁与CuSO4溶液反应,能置换出铜。()答案:(1)×(2)×(3)×(4)×(5)×(6)√2.日常生活中的铁制品为什么易生锈?铁锈的主要成分是什么?提示:日常生活中的铁制品不纯、常含有碳等杂质。铁制品在潮湿的空气中易发生电化学腐蚀而生锈。铁锈的主要成分是Fe2O3。3.铁的化学性质活泼,为什么可以用铁罐贮存和运输浓硫酸和浓硝酸?提示:常温下,铁遇浓H2SO4、浓硝酸发生“钝化”。4.能否通过化合反应的方法制得FeCl3、FeCl2、Fe(OH)3?若能,写出反应的化学方程式。提示:能;2Fe+3Cl2=====2FeCl3,2FeCl3+Fe===3FeCl2,4Fe(OH)2+O2+2H2O===4Fe(OH)3铁反应后元素价态的判断方法(1)铁与弱氧化剂(如:S、I2、H+、Fe3+、Cu2+)等反应所得产物为Fe2+,铁元素的价态为+2价,如:Fe+I2=====FeI2。(2)铁与强氧化剂(如:Cl2、Br2、浓H2SO4、硝酸等)反应所得产物为Fe3+,铁元素的价态为+3价。如2Fe+3Br2===2FeBr3。(3)铁在纯氧中燃烧得到的产物为Fe3O4,铁元素的价态为+2、+3价。(4)铁与稀硝酸反应产物的判断:①当HNO3过量时:反应原理:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,铁元素的存在形式为Fe3+,铁元素的价态为+3价。②当Fe过量时:反应原理:3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O,铁元素的存在形式为Fe2+,铁元素的价态为+2价。③当<<时:铁元素的存在形式为Fe2+和Fe3+,铁元素的价态为+2、+3价。1.下列物质反应后一定有+3价铁生成的是________。①过量的Fe与Cl2加热时发生反应②Fe与过量稀H2SO4反应后,再向其中加KNO3③Fe与过量的S加热时发生反应2④Fe(NO3)2溶液中加少量盐酸⑤Fe和Fe2O3的混合物溶于盐酸中2.在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。①Fe3+②Fe2+③Fe、Fe2+④Fe2+、Fe3+(1)AB段铁元素以________形式存在。(2)BC段铁元素以________形式存在。(3)CD段铁元素以________形式存在。[答案专区]1.解析:Fe与Cl2反应只生成FeCl3;Fe与S反应只生成FeS;Fe――→Fe2+――→Fe3+;Fe2+――→Fe3+;Fe2O3溶于盐酸生成Fe3+,当混合物中Fe不足时,溶液中仍有Fe3+,当Fe足量时,溶液中无Fe3+。答案:①②④2.解析:向稀硝酸中加入铁粉,开始时稀硝酸过量应生成Fe3+,故AB段铁元素以Fe3+形式存在。随着铁粉的增加,溶液中的Fe3+与Fe反应生成Fe2+。故最终全部转化成Fe2+,而CD段铁元素以Fe2+形式存在。答案:(1)①(2)④(3)③铁的氧化物与氢氧化...