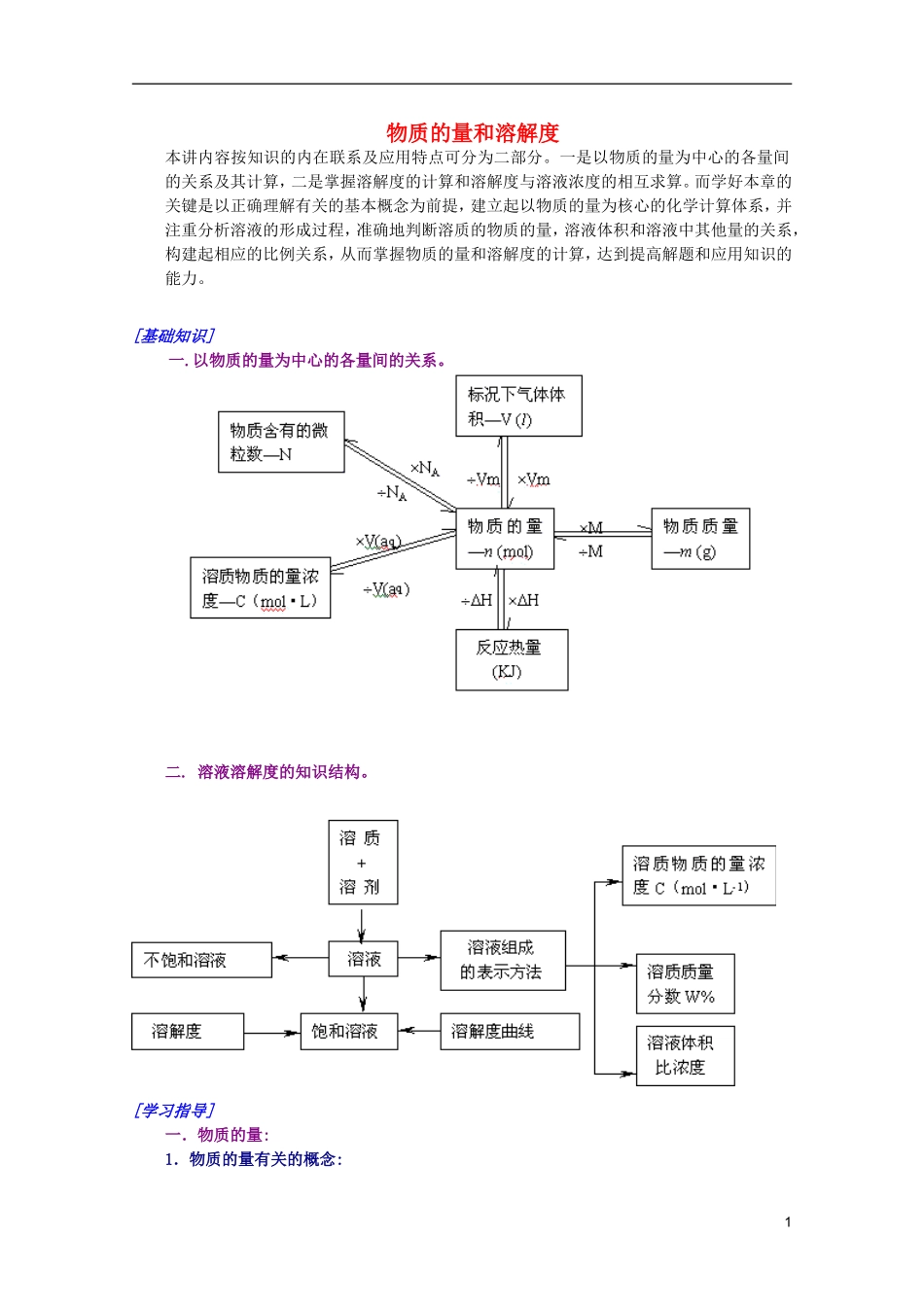
物质的量和溶解度本讲内容按知识的内在联系及应用特点可分为二部分。一是以物质的量为中心的各量间的关系及其计算,二是掌握溶解度的计算和溶解度与溶液浓度的相互求算。而学好本章的关键是以正确理解有关的基本概念为前提,建立起以物质的量为核心的化学计算体系,并注重分析溶液的形成过程,准确地判断溶质的物质的量,溶液体积和溶液中其他量的关系,构建起相应的比例关系,从而掌握物质的量和溶解度的计算,达到提高解题和应用知识的能力。[基础知识]一.以物质的量为中心的各量间的关系。二.溶液溶解度的知识结构。[学习指导]一.物质的量:1.物质的量有关的概念:1物质的量在化学计算中处于核心的地位,与它相关的概念有五个。(1)物质的量(n)以0.012kg所含的原子数目即阿伏加德罗常数NA(近似值6.02个mol-1)为计数标准,用来表示物质(或一定量微粒集体中)所含粒子数目(N)多少的物理量。摩尔(mol)是它的单位。每摩尔物质含阿伏加德罗常数个微粒。使用摩尔为单位,必须指明粒子的种类,它们可以是分子、原子、离子、电子、质子和中子等微粒或这些粒子的特定组合。物质的量与粒子数关系:(2)摩尔质量(M)单位物质的量的物质所具有的质量,单位g·mol-1或kg·mol-1。1mol任何粒子或物质的质量以克为单位时在数值上都与该粒子相对原子质量或相对分子质量相等。物质的量与物质质量关系:(3)气体摩尔体积(Vm)在标准状况下,单位物质的量的气体所占有的体积,单位L·mol-1或m3·mol-1。大量实验证明,标况下,1mol任何气体所占的体积都约为22.4L,因此,我们可以认为22.4L·mol-1是特定条件下的气体摩尔体积。气体物质的量与气体体积关系:(4)溶质物质的量浓度(CB)单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,单位mol·L-1或mol·m-3。溶质的物质的量和溶液中溶质的物质的量浓度关系:溶质物质的量和溶液中溶质的质量分数(W)溶液体积(V)密度(ρ)的关系:。计算时注意单位的换算。(5)反应热(△H)化学反应过程中放出或吸收的热量,单位一般采用KJ·mol-1。△H<0为放热反应,△H>0为吸热反应。反应热可以分为多种,如燃烧热,指101kpa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量。在稀溶液中酸与碱发生中和反应生成1molH2O时的反应热叫做中和热。通常一定物质的量的某物质在燃烧过程中放出的热量(Q)的关系是。2.阿伏加德罗定律及其推论。阿伏加德罗定律是指:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。而我们在学习过程中,需在正确理解阿伏加德罗定律内容的基础上注意下列重要推论。(1)两个等同条件下的正比关系。推论Ⅰ:同温同压下,任何气体的体积之比等于其物质的量之比。推论Ⅱ:同温同压下,任何气体的密度之比等于其摩尔质量之比。2推论Ⅲ:同温同体积下,任何气体的压强之比等于其物质的量之比。(2)三个等同条件下的反比关系。推论Ⅳ:同温同压同质量下,任何气体的体积之比与其摩尔质量成反比。推论Ⅴ:同温同体积同质量下,任何气体的压强之比与其摩尔质量成反比。这些结论均总结于理想气体的状态方程式,在方程式中,改变p、v、n等变量即可推得以上关系式。3.有关气体摩尔质量的计算.(1)(ρg·L-1是标准状况与气体的密度)(2)(3)混合气体的摩尔质量()===…Mi为各气体的摩尔质量,Vi%为体积分数V1%+V2%+…+Vi%=14.溶液中微粒的浓度以Al2(SO4)2为例,设Al2(SO4)3的物质的量浓度为amol·L-1则(1)C(Al3+)=2amol·L-1,C(SO42-)=3amol·L-1(2)设Al2(SO4)3溶液中C(Al3+)=bmol·L-1则C(SO42-)=bmol·L-1C[Al2(SO4)3]=bmol·L-1∴C[Al2(SO4)3]:C(Al3+):C(SO42-)=1:2:3(3)溶液中电荷守恒:3C(Al3+)=2C(SO42-)二.有关溶解度的计算:1.溶解度计算题的特点。一是关于对溶解度概念的基本运算或根据物质溶解度曲线的有关计算。二是温度不变时,蒸发溶剂或加入溶剂时,饱和溶液析出或溶解溶质的质量;溶剂不变,改变温度,饱和溶液析出或溶解溶质的质量的计算,这类计算常伴有分析、推理、判断的过程,题目有一定的综合性,能力要求较高,有益于思维的训练与培养。2.溶解平衡与溶解度.(1...