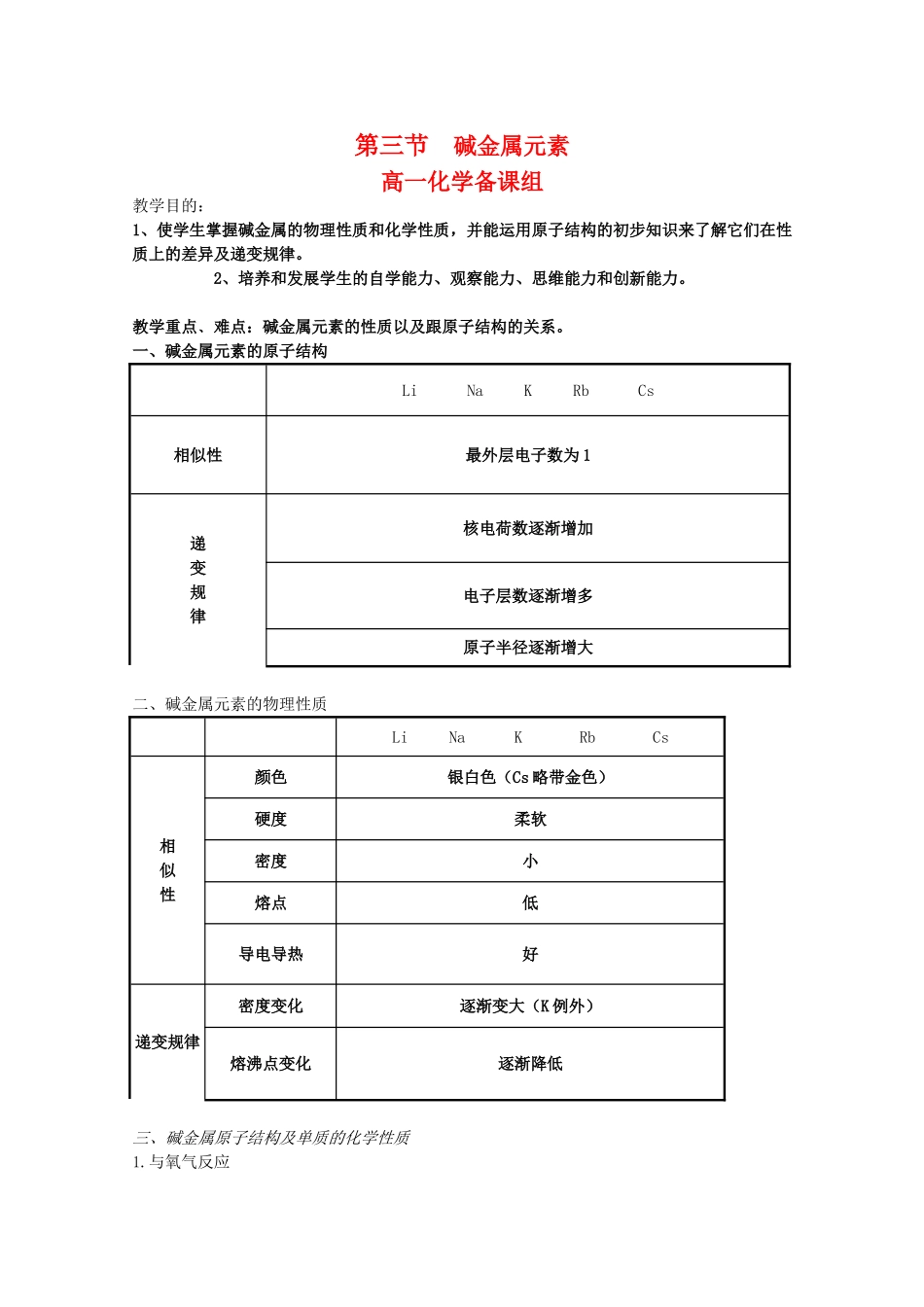
第三节碱金属元素高一化学备课组教学目的:1、使学生掌握碱金属的物理性质和化学性质,并能运用原子结构的初步知识来了解它们在性质上的差异及递变规律。2、培养和发展学生的自学能力、观察能力、思维能力和创新能力。教学重点﹑难点:碱金属元素的性质以及跟原子结构的关系。一、碱金属元素的原子结构LiNaKRbCs相似性最外层电子数为1递变规律核电荷数逐渐增加电子层数逐渐增多原子半径逐渐增大二、碱金属元素的物理性质LiNaKRbCs相似性颜色银白色(Cs略带金色)硬度柔软密度小熔点低导电导热好递变规律密度变化逐渐变大(K例外)熔沸点变化逐渐降低三、碱金属原子结构及单质的化学性质1.与氧气反应钾在空气中燃烧实验实验现象:钾熔化成闪亮的液球(与钠相同),钾球很快就剧烈燃烧起来(比钠燃烧更容易、更剧烈),燃烧时有火焰(与钠燃烧相同),火焰呈紫色(与钠燃烧不同)。实验结论:在加热的条件下,钾在空气中比钠更容易燃烧。钾比钠更活泼、金属性更强。4Li+O2====2Li2O4Na+O2====2Na2O2Na+O2====Na2O2(过氧化钠,淡黄色)2K+O2====K2O2(过氧化钾,淡黄色)K+O2====KO2(超氧化钾)碱金属与非金属反应的总结[小结]在室温时,铷和铯遇到空气就会立即燃烧。钾、铷等碱金属与氧气反应,生成比过氧化物更复杂的氧化物。除与氧反应外,碱金属还能与氯气等大多数非金属起反应,表现出很强的还原性,且还原性从锂到铯逐渐增强。实验切取绿豆大小的一小块钾投入冷水(滴有2滴酚酞试液)中,现象:(学生观察描述)反应剧烈,钾熔成小球在液面快速游动,生成的氢气燃烧,并发生轻微爆炸。反应后溶液变红。2K+2H2O=2KOH+H2↑结论:钾的还原性比钠更强②与水反应2R+2H2O=2ROH+H2↑Li:剧烈、生成H2Na:更剧烈、生成H2K:轻微的爆炸生成H2Rb、Cs:遇水立即燃烧爆炸小结:(1)相似性•均为活泼金属,可作强还原剂•都能与水反应,生成氢氧化物和氢气•都能与氧气等非金属反应生成离子化合物(2)递变性(从锂到铯)•与氧气反应越来越剧烈,且相同条件下产物越来越复杂(Li2ONa2O2KO2)•与水反应越来越剧烈•金属性(还原性)逐渐增强四、焰色反应:1、定义:某些金属或金属化合物灼烧时使火焰呈现特殊的颜色,在化学上叫做焰色反应。2、操作:洗→烧→蘸→烧3、常见金属元素的焰色反应钠:黄色钾:紫色4、说明:(1)﹑焰色反应是某种元素的性质.(2)﹑焰色反应是物理性质.(3)﹑应用:鉴别K2CO3和Na2CO3(4)观察钾的焰色反应时,要透过蓝色钴玻璃片五、碱金属的保存方法:除Li特别外,其于的皆保存在煤油中。六、常用的钾肥:KCl、K2SO4、K2CO3(草木灰的主要成分)等。课堂练习:1、下列有关碱金属元素的叙述中,错误的是:A、单质是很强的还原剂B、碱金属密度都比水小C、从Li到Cs,单质的熔沸点逐渐降低D、从Li到Cs,单质的还原性逐渐增强2、焰色反应每次实验都要用试剂洗净铂丝,这种试剂是A.Na2CO3溶液B.NaOH溶液C.硫酸溶液D.稀盐酸[解题规律与技巧]贮存试剂的方法:贮存时应考虑以下诸因素:物质本身结构和性质,周围环境和盛放物质的容器等。其贮存方法可归纳如下:(1)易挥发性物质需密封保存.如浓硝酸、浓盐酸、浓氨水以及很多低沸点有机物等。(2)易风化的物质,易吸收水分的物质需密封保存:如CaCl2,浓硫酸,碳化钙,变色硅胶,可溶性酸酐的固体,易溶性碱性氧化物的固体,十水碳酸钠,固体氢氧化钠;易水解的氯化铝,氯化锡等.(3)易吸收空气中的二氧化碳的物质需密封保存:如氢氧化钠、过氧化钠、石灰水、次氯酸钙、水玻璃等。(4)易被空气中氧气氧化的物质需密封保存:如氢氧化铁、亚铁盐、亚硫酸及其盐、氢硫酸等。(5)因光照或受热而变质需用棕色瓶且密封保存:如硝酸银、浓硝酸、氯化银、溴化银、双氧水、溴水、氯水等。(6)盛放的试剂不能与容器(包括瓶塞)发生反应.如氢氧化钠及其它碱性物质不能用玻璃塞,汽油、溴或溴水不能盛放在带橡皮塞的玻璃瓶中,盛氢氟酸或可溶性氟化物的溶液的试剂瓶不能用玻璃瓶.(7)某物质保存于另一物质中,应考虑到两种物质间不能起反应:如钠、钾、锂均不能保存于水中,应将钠、钾保存于煤油中,而锂保存于石蜡中,因锂的密度小于煤油的密度...