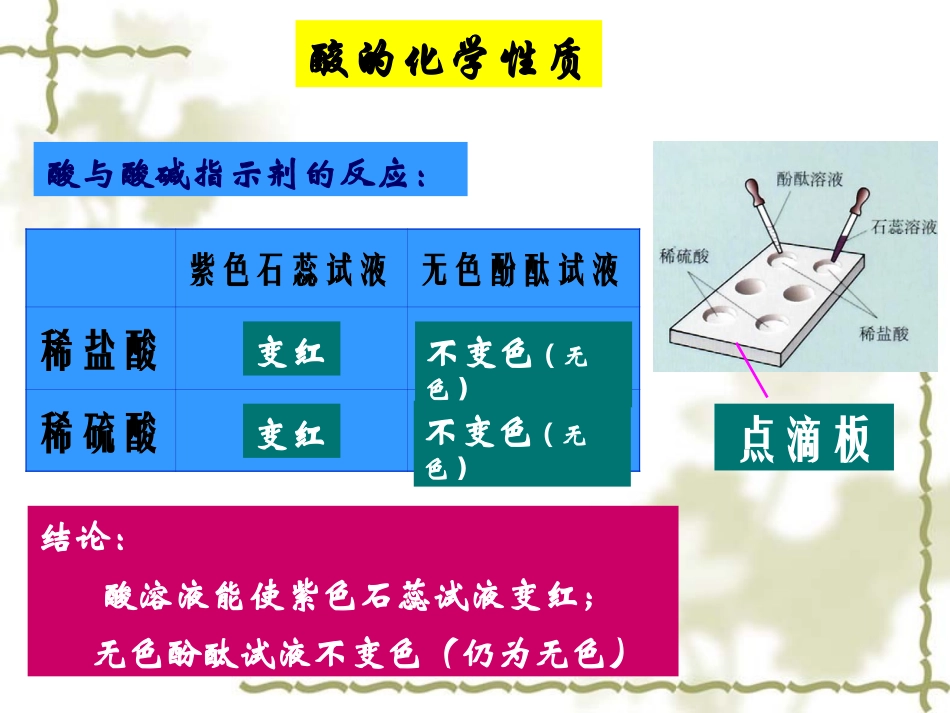
酸和碱的化学性质物质纯净物混合物化合物氧化物酸碱盐单质金属非金属金属氧化物非金属氧化物酸的化学性质酸与酸碱指示剂的反应:点滴板紫色石蕊试液无色酚酞试液稀盐酸稀硫酸变红变红不变色(无色)不变色(无色)结论:酸溶液能使紫色石蕊试液变红;无色酚酞试液不变色(仍为无色)酸的化学性质写出下列化学方程式:与稀盐酸的反应与稀硫酸的反应镁锌铁Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑Zn+H2SO4=ZnSO4+H2↑Mg+H2SO4=MgSO4+H2↑结论:酸能与氢前金属反应制取氢气酸的化学性质酸与金属氧化物的反应现象化学方程式铁锈+盐酸铁锈+硫酸Fe2O3+6HCl=2FeCl3+3H2O铁钉表面的铁锈被除去,溶液变为黄色铁钉表面的铁锈被除去,溶液变为黄色Fe2O3+3H2SO4=Fe2(SO4)3+3H2O结论:酸能与金属氧化物反应酸跟盐发生的反应酸跟盐发生的反应已知鸡蛋壳的主要成分是碳酸钙,知识回忆已知鸡蛋壳的主要成分是碳酸钙,知识回忆↙↙+=CaCOCaCO33+2HCl=CaCl+2HCl=CaCl22+H+H22O+COO+CO22↑↑酸的化学性质补充补充11:盐酸:盐酸跟硝酸银的反应跟硝酸银的反应现象现象分析分析有白色沉淀生成有白色沉淀生成AgNOAgNO33+HCl+HCl=AgCl=AgCl↓↓+HNO+HNO33实验步骤:实验步骤:在盛有少量稀盐酸的试管在盛有少量稀盐酸的试管中滴入几滴硝酸银溶液,观察现象。中滴入几滴硝酸银溶液,观察现象。氯化银沉淀不溶于水,也不溶于稀硝酸。根据这一特性,硝酸氯化银沉淀不溶于水,也不溶于稀硝酸。根据这一特性,硝酸银溶液(银溶液(AgNOAgNO22)是检验氯离子)是检验氯离子(Cl(Cl--))的试剂,可用于检验盐酸的试剂,可用于检验盐酸和其他在溶液中能产生和其他在溶液中能产生氯离子氯离子(Cl(Cl--))的化合物。的化合物。(KCl(KCl、、MgClMgCl22等等))补充补充22:硫酸:硫酸跟氯化钡的反应跟氯化钡的反应现象现象分析分析有白色沉淀生成有白色沉淀生成实验步骤:实验步骤:在盛有少量稀硫酸的试管中滴入几在盛有少量稀硫酸的试管中滴入几滴氯化钡的溶液,观察现象滴氯化钡的溶液,观察现象HH22SOSO44+BaCl+BaCl22=BaSO=BaSO44↓↓+2HCl+2HCl【【小结小结】】【【小结小结】】酸的化学性质酸的化学性质•11、、跟指示剂的反应跟指示剂的反应•22、、跟金属的反应跟金属的反应•33、、跟金属氧化物的反应跟金属氧化物的反应•44、、跟碱的反应跟碱的反应•55、、跟某些盐反应跟某些盐反应石蕊试液遇酸变成石蕊试液遇酸变成红色红色,酚酞试液遇,酚酞试液遇酸酸不变色不变色。。酸酸++金属金属====盐盐++氢气氢气↑↑FeFe22OO33+6HCl=2FeCl+6HCl=2FeCl33+3H+3H22OO•金属氧化物金属氧化物++酸酸====盐盐++水水NaOH+HCl=NaCl+HNaOH+HCl=NaCl+H22OO酸酸++碱碱====盐盐++水水酸的化学性质酸的化学性质酸+盐=新酸+新盐HCl+AgNO3=HNO3+AgCl↓1.1.碱溶液能使紫色的石蕊溶液变碱溶液能使紫色的石蕊溶液变色,使无色的色,使无色的酚酞溶液变酚酞溶液变色。色。2.2.碱能与某些非金属氧化物反应碱能与某些非金属氧化物反应二、碱的化学性质二、碱的化学性质二、碱的化学性质二、碱的化学性质2NaOH+CO2NaOH+CO22==Ca(OH)Ca(OH)22+CO+CO22=CaCO=CaCO33↓↓+H+H22OO((检验检验COCO22))氢氧化钠放置在空气中会发生变质,所以氢氧氢氧化钠放置在空气中会发生变质,所以氢氧化钠必须密封保存。化钠必须密封保存。NaNa22COCO33+H+H22OO蓝红3.3.碱能与盐的反应碱能与盐的反应2NaOH+CuSO4===Cu(OH)2↓+Na2SO4写出澄清石灰水分别和硫酸铜溶液和氯化铁溶液反应的化学方程式Ca(OH)2+CuSO4===Cu(OH)2↓+CaSO43Ca(OH)2+2FeCl3===2Fe(OH)3↓+3CaCl2由两种化合物互相交换成分,生成另外两种化合物的反应——复分解反应。通式:AB+CD==AD+CB特点:反应前后元素化合价不变化学基本反应类型之一初中化学四个个基本反应类型a化合反应b分解反应c置换反应d复分解反应【【思考思考】】不同的酸为什么有相似的化学性质?不同的酸为什么有相似的化学性质?不同的碱为什么也有相似的化学性质?不同的碱为什么也有相似的化学性质?HCl→HHCl→H+++Cl+Cl--HH22SOSO44→2H→2H+++SO+SO442-2-NaOH→NaOH→NaNa++++OHOH...