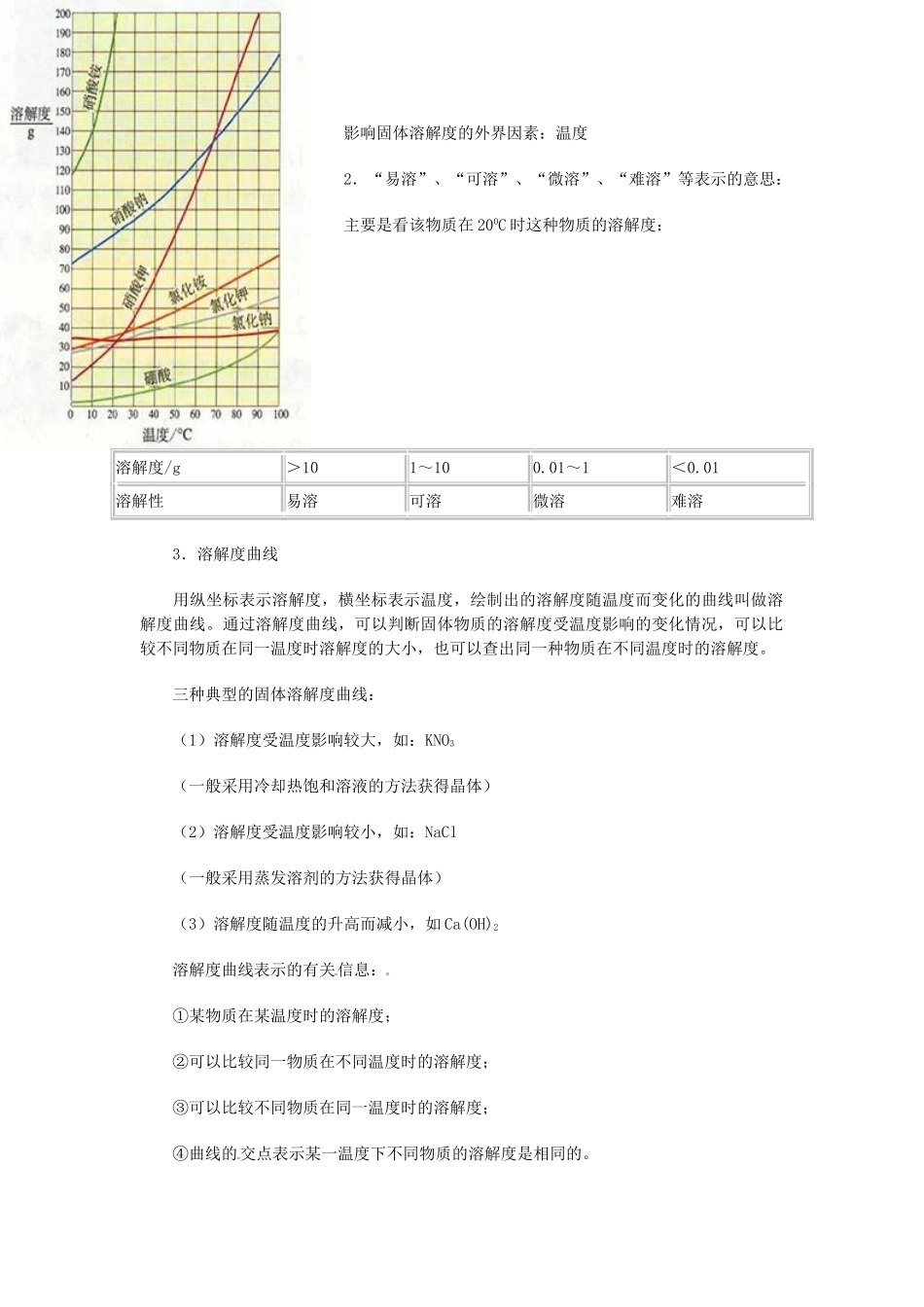
溶解度【主要内容】饱和溶液和不饱和溶液以及溶解度的理解和应用【知识要点】一、饱和溶液和不饱和溶液1、定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做饱和溶液,还能继续溶解的溶液叫做不饱和溶液。说明:(1)饱和溶液二要素:“一定温度下”“一定量的溶剂”。(2)某物质的饱和溶液中还可以继续溶解其它物质。(3)如何判断某溶液是否饱和?向该溶液中加入少量的溶质,看能否继续溶解。2、不饱和溶液与饱和溶液间的相互转化:特殊:Ca(OH)2溶解于水时,温度越高,溶解越少;温度越低,溶解越多。3、结晶:(1)定义:溶质从饱和溶液中以晶体的形式析出的过程(2)有晶体析出后的溶液叫母液,它一定是饱和溶液。(3)结晶的方法:a.蒸发溶剂b.冷却热饱和溶液人们利用以上的原理从海水中提取食盐并得到含有大量化工原料的母液(叫苦卤)其大致过程如下:问题:你认为它是通过什么方法获得食盐晶体的?——蒸发溶剂[知识拓展]二、溶解度(一)固体溶解度1.概念:在一定温度下,某固态物质在100g溶剂(通常溶剂为水)里达到饱和状态时所溶解的质量。溶解度的概念包括四个要素:①指明一定温度;②溶剂为100g;③必须达到饱和状态;④单位为g。影响固体溶解度的外界因素:温度2.“易溶”、“可溶”、“微溶”、“难溶”等表示的意思:主要是看该物质在200C时这种物质的溶解度:溶解度/g>101~100.01~1<0.01溶解性易溶可溶微溶难溶3.溶解度曲线用纵坐标表示溶解度,横坐标表示温度,绘制出的溶解度随温度而变化的曲线叫做溶解度曲线。通过溶解度曲线,可以判断固体物质的溶解度受温度影响的变化情况,可以比较不同物质在同一温度时溶解度的大小,也可以查出同一种物质在不同温度时的溶解度。三种典型的固体溶解度曲线:(1)溶解度受温度影响较大,如:KNO3(一般采用冷却热饱和溶液的方法获得晶体)(2)溶解度受温度影响较小,如:NaCl(一般采用蒸发溶剂的方法获得晶体)(3)溶解度随温度的升高而减小,如Ca(OH)2溶解度曲线表示的有关信息:①某物质在某温度时的溶解度;②可以比较同一物质在不同温度时的溶解度;③可以比较不同物质在同一温度时的溶解度;④曲线的交点表示某一温度下不同物质的溶解度是相同的。⑤物质的溶解度受温度影响的变化情况;(二)气体的溶解度1.概念:气体的溶解度是指在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。影响气体溶解度的因素:温度和压强。一般情况下,气体的溶解度随外界压强的增大而增大;随温度的升高而降低。气体溶解度在实际测定时比较复杂,非标准状况下的数据还应该换算成标准状况下的值。固体溶解度和气体溶解度的比较:固体溶解度气体溶解度外界条件在一定温度下在压强为101kPa和一定温度时衡量标准溶剂(通常指水)量为100g1体积水里溶液状态饱和饱和单位溶解溶质的质量(克g)溶解气体的体积(无单位)影响其大小的外界因素温度温度和压强【例题解析】1.下图是甲乙两种固体物质的溶解度曲线。据图回答:(1)P点的含义是_______________________。(2)20℃时要使接近饱和的甲溶液变成饱和溶液,可采用的方法有_________(写出一种)(3)当甲中含有少量乙时,可采用____________的方法提纯甲。(4)30℃时,将40g甲物质放入盛有50g水的烧杯中,所得溶液溶质的质量分数为____;若将烧杯内物质升温到50℃(不考虑水蒸发),溶液中变化的是_____(选填A、B、C、D)A.溶剂的质量B.溶液的质量C.溶质的质量分数D.以上都不变【分析】本题主要考查溶解度曲线的含义以及关于饱和溶液和不饱和溶液之间的相互转化。(1)对于溶解度曲线上任意一点表示该物质在某温度下的溶解度,所以P点的含义是:30℃时,甲的溶解度为60g。(2)甲物质的溶解度随着温度的升高而增加,所以可以采取蒸发溶剂或者降温的方法使接近饱和的甲溶液变成饱和溶液。(3)对于乙而言,其溶解度随温度的变化不大,所以甲中含有少量乙时,可以采取冷却热的饱和的甲溶液。(4)30℃时,甲物质的溶解度是60g,意味着在这个温度下,100g水中最多溶解甲60g,所以,,50g水中最多溶解30g...