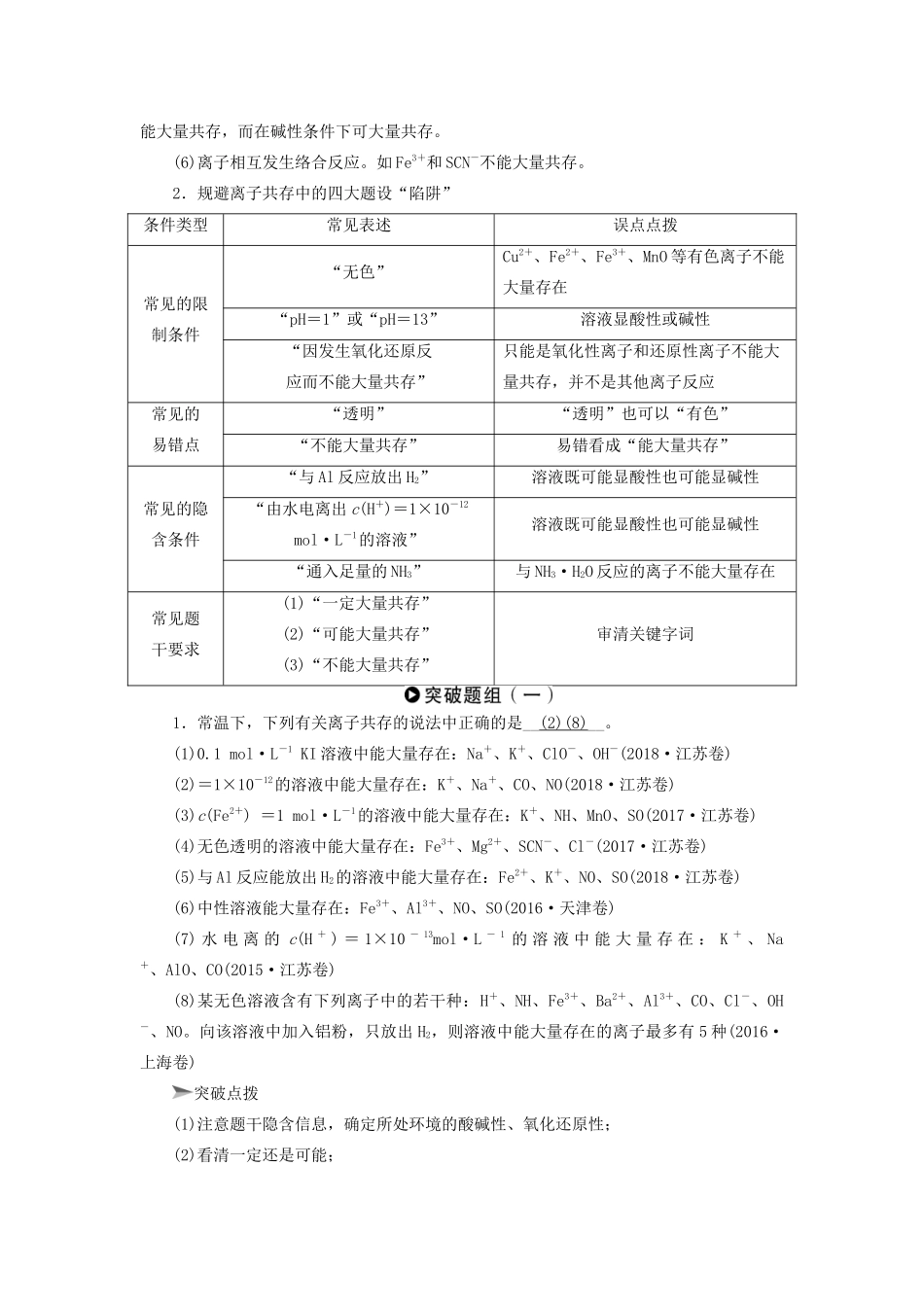
第4讲离子反应知考点明方向满怀信心正能量设问方式①离子共存的判断[例](2018·江苏卷,4),(2017·江苏卷,9)②离子方程式书写及正误判断[例](2018·江苏卷,6),(2017·海南卷,6)③常见离子的鉴别及推断[例](2018·全国卷Ⅰ,27),(2017·江苏卷,6)知识点网络线引领复习曙光现释疑难研热点建模思维站高端考点一离子共存的判断▼命题规律:1.题型:选择题(主),填空题(次)。2.考向:离子共存主要有两类:无限制条件的离子共存和有限制条件的离子共存。▼方法点拨:1.明确离子“反应不共存,共存不反应”六大条件(1)离子相互结合生成难溶物质。如Ca2+和CO生成难溶性盐CaCO3,H+和SiO生成难溶性酸H2SiO3,Cu2+和OH-生成难溶性碱Cu(OH)2等。(2)离子相互结合生成气态物质。如H+和S2-生成H2S,H+和HCO生成CO2,NH和OH-生成NH3等。(3)离子相互结合生成弱电解质。如H+与OH-、PO、CH3COO-等分别结合生成弱电解质H2O、H3PO4、CH3COOH等。(4)离子相互促进水解。如Al3+、Fe3+分别与AlO、HCO、CO、S2-等发生水解相互促进的反应,生成沉淀或气体。(5)离子互相氧化还原反应①具有较强氧化性的离子(如MnO、ClO-、Fe3+等)与具有较强还原性的离子(如Fe2+、S2-、I-、SO等)不能大量共存。②NO与I-,S2-与SO,Cl-与ClO-等在酸性条件下不能大量共存,而在碱性条件下可大量共存。(6)离子相互发生络合反应。如Fe3+和SCN-不能大量共存。2.规避离子共存中的四大题设“陷阱”条件类型常见表述误点点拨常见的限制条件“无色”Cu2+、Fe2+、Fe3+、MnO等有色离子不能大量存在“pH=1”或“pH=13”溶液显酸性或碱性“因发生氧化还原反应而不能大量共存”只能是氧化性离子和还原性离子不能大量共存,并不是其他离子反应常见的易错点“透明”“透明”也可以“有色”“不能大量共存”易错看成“能大量共存”常见的隐含条件“与Al反应放出H2”溶液既可能显酸性也可能显碱性“由水电离出c(H+)=1×10-12mol·L-1的溶液”溶液既可能显酸性也可能显碱性“通入足量的NH3”与NH3·H2O反应的离子不能大量存在常见题干要求(1)“一定大量共存”(2)“可能大量共存”(3)“不能大量共存”审清关键字词1.常温下,下列有关离子共存的说法中正确的是__(2)(8)__。(1)0.1mol·L-1KI溶液中能大量存在:Na+、K+、ClO-、OH-(2018·江苏卷)(2)=1×10-12的溶液中能大量存在:K+、Na+、CO、NO(2018·江苏卷)(3)c(Fe2+)=1mol·L-1的溶液中能大量存在:K+、NH、MnO、SO(2017·江苏卷)(4)无色透明的溶液中能大量存在:Fe3+、Mg2+、SCN-、Cl-(2017·江苏卷)(5)与Al反应能放出H2的溶液中能大量存在:Fe2+、K+、NO、SO(2018·江苏卷)(6)中性溶液能大量存在:Fe3+、Al3+、NO、SO(2016·天津卷)(7)水电离的c(H+)=1×10-13mol·L-1的溶液中能大量存在:K+、Na+、AlO、CO(2015·江苏卷)(8)某无色溶液含有下列离子中的若干种:H+、NH、Fe3+、Ba2+、Al3+、CO、Cl-、OH-、NO。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有5种(2016·上海卷)突破点拨(1)注意题干隐含信息,确定所处环境的酸碱性、氧化还原性;(2)看清一定还是可能;(3)记住常见离子的反应特征。解析(1)ClO-氧化性很强,可将碘离子氧化,错误。(2)=1×10-12的溶液呈碱性,K+、Na+、CO、NO可以大量存在,正确。(3)Fe2+有还原性,会被MnO氧化,错误。(4)Fe3+有颜色,且Fe3+可以与SCN-反应生成血红色的Fe(SCN)3溶液,错误。(5)与Al反应能放出H2的溶液,既可能显酸性也可能显碱性,其中碱性时Fe2+会生成Fe(OH)2沉淀;酸性时,Fe2+会被NO氧化,错误。(6)中性环境下Fe3+会生成Fe(OH)3沉淀,错误。(7)水电离的c(H+)=1×10-13mol·L-1的溶液,pH可能为13或者1,pH若为13,则K+、Na+、AlO、CO可以大量共存;pH若为1,则弱酸根AlO、CO不能大量存在,错误。(8)无色溶液中一定不存在有色的Fe3+;溶液中加入金属铝,发生反应并放出H2,溶液可能呈酸性,也可能呈碱性,若溶液为酸性,则不存在OH-、NO、CO,阴离子只能为Cl-,阳离子可以为H+、NH、Ba2+、Al3+,最多存在5种离子;若呈碱...