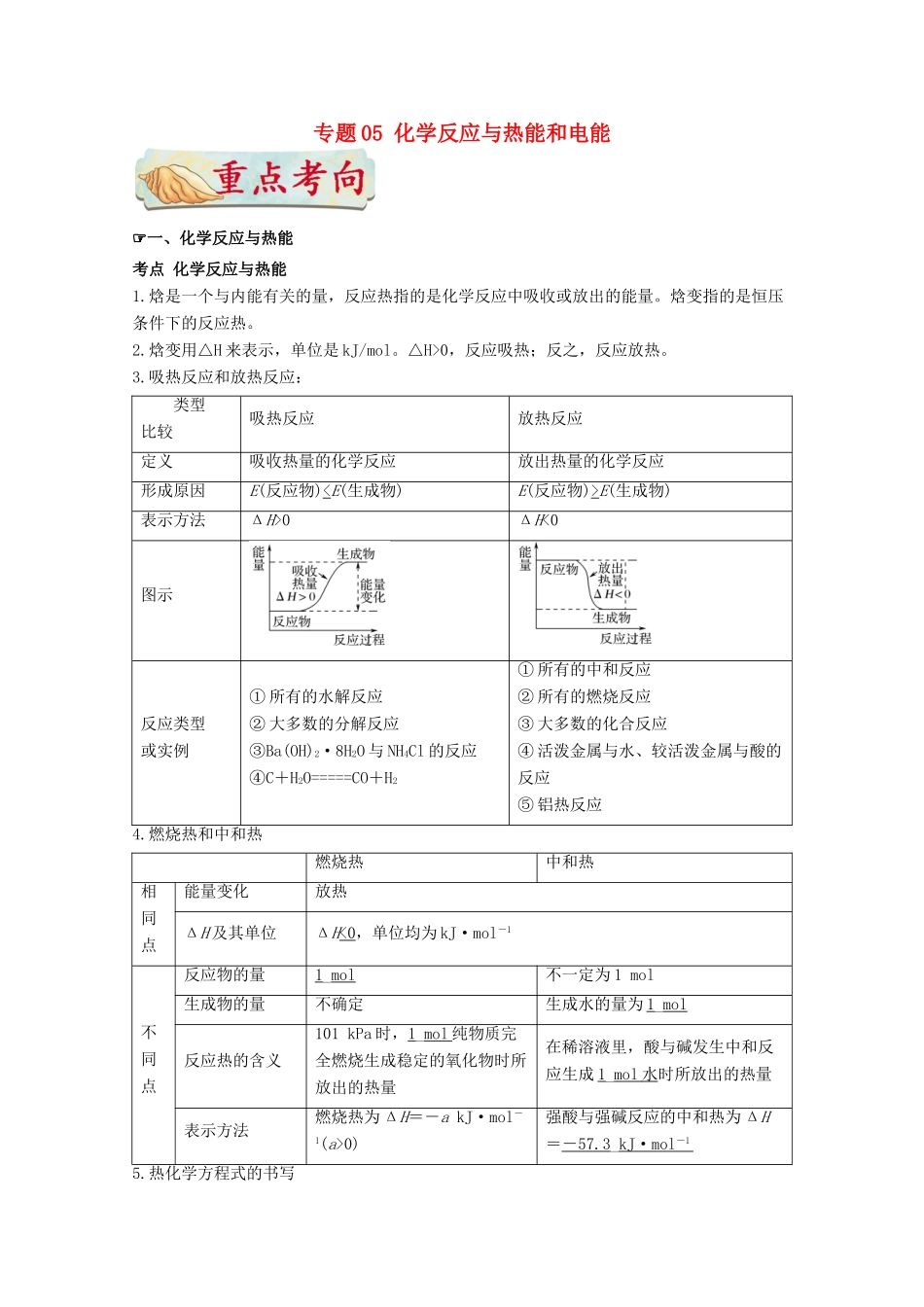
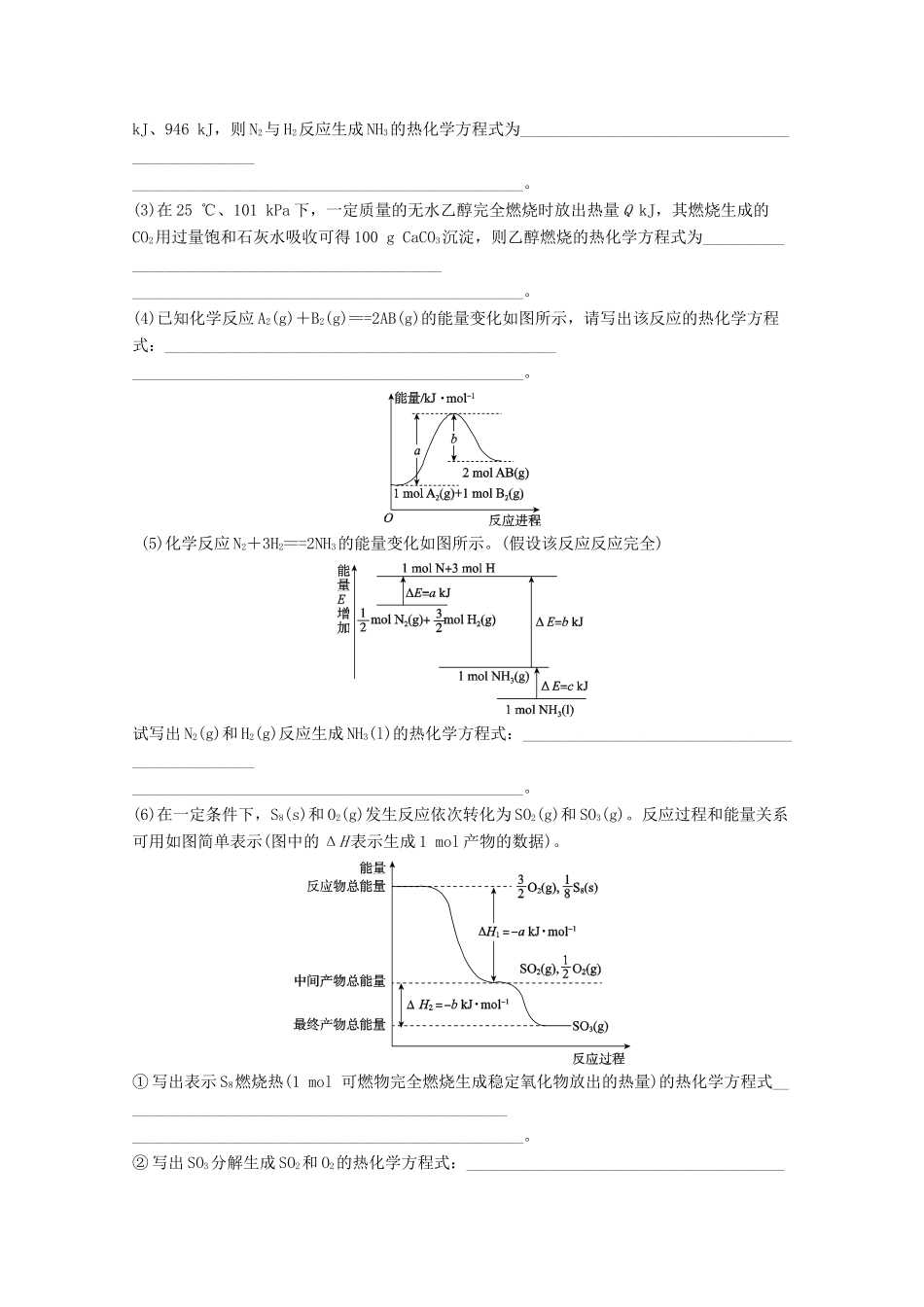
专题05化学反应与热能和电能☞一、化学反应与热能考点化学反应与热能1.焓是一个与内能有关的量,反应热指的是化学反应中吸收或放出的能量。焓变指的是恒压条件下的反应热。2.焓变用△H来表示,单位是kJ/mol。△H>0,反应吸热;反之,反应放热。3.吸热反应和放热反应:类型比较吸热反应放热反应定义吸收热量的化学反应放出热量的化学反应形成原因E(反应物)E(生成物)表示方法ΔH>0ΔH<0图示反应类型或实例①所有的水解反应②大多数的分解反应③Ba(OH)2·8H2O与NH4Cl的反应④C+H2O=====CO+H2①所有的中和反应②所有的燃烧反应③大多数的化合反应④活泼金属与水、较活泼金属与酸的反应⑤铝热反应4.燃烧热和中和热燃烧热中和热相同点能量变化放热ΔH及其单位ΔH<0,单位均为kJ·mol-1不同点反应物的量1_mol不一定为1mol生成物的量不确定生成水的量为1_mol反应热的含义101kPa时,1_mol纯物质完全燃烧生成稳定的氧化物时所放出的热量在稀溶液里,酸与碱发生中和反应生成1_mol水时所放出的热量表示方法燃烧热为ΔH=-akJ·mol-1(a>0)强酸与强碱反应的中和热为ΔH=-57.3_kJ·mol-15.热化学方程式的书写例1.5g火箭燃料二甲基肼(CH3—NH—NH—CH3)完全燃烧,放出50kJ热量,则二甲基肼的燃烧热ΔH为()A.-1000kJ·mol-1B.-1500kJC.-2000kJ·mol-1D.-2000kJ【答案】C例2.(2015·河南十校联考,4)如图表示白磷(P4)分子结构。白磷在氧气不足时燃烧生成P4O6,P4O6分子结构可以看成是白磷分子中磷磷键之间插入氧原子。已知:键能表示断裂1mol化学键需要吸收的能量。几种共价键的键能如下表所示:化学键P—PP—OP===OO===O键能/(kJ·mol-1)abcd则P4(s)+3O2(g)===P4O6(s)的反应热(ΔH)为()A.(6a+3d-12b-4c)kJ·mol-1B.(4a+3d-8d)kJ·mol-1C.(6a+3d-12b)kJ·mol-1D.(6a+3d+4c-12b)kJ·mol-1【答案】C例3.(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为________________________________________________________________________________________________。(2)已知拆开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________________________________________________________。(3)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为________________________________________________________________________________________________。(4)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:________________________________________________________________________________________________。(5)化学反应N2+3H2===2NH3的能量变化如图所示。(假设该反应反应完全)试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:________________________________________________________________________________________________。(6)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用如图简单表示(图中的ΔH表示生成1mol产物的数据)。①写出表示S8燃烧热(1mol可燃物完全燃烧生成稳定氧化物放出的热量)的热化学方程式________________________________________________________________________________________________。②写出SO3分解生成SO2和O2的热化学方程式:________________________________________________________________________________________________。【答案】(1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)ΔH=-1427.2kJ·mol-1(2)N2(g)+3H2(g)===2NH3(g)ΔH=-92kJ·mol-1(3)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-2QkJ·mol-1(4)A2(g)+B2(g)===2AB(g)ΔH=(a-b)kJ·mol-1(5)N2(g)+3H2(g)===2NH3(l)ΔH=-2(b+c-a)kJ·mol-1(6)①S8(s)+8O2...