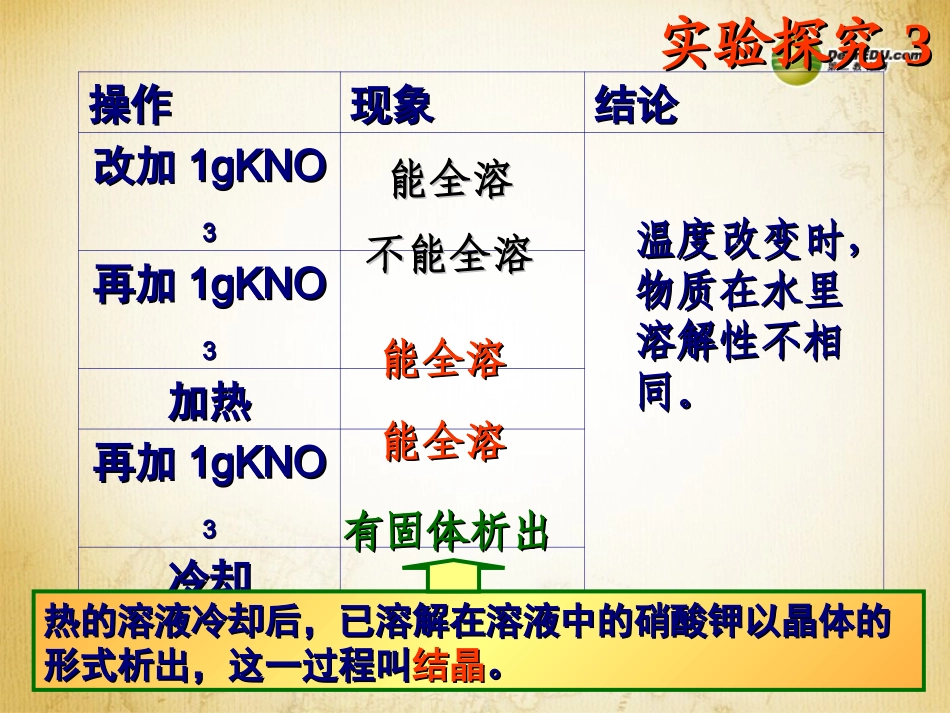
课题课题22溶解度溶解度实验探究实验探究11操作操作向1gNaCl中加入4mL蒸馏水,充分振荡再加入再加入1g1g氯化氯化钠,搅拌钠,搅拌现象现象结论结论能全溶能全溶不能全溶不能全溶物质不能无限制地溶解在一定量的水中物质不能无限制地溶解在一定量的水中【实验探究2】在上述不能溶的NaCl的试管中,加入3mL蒸馏水,充分振荡。能否溶解与溶剂的量有关实验探究实验探究33操作操作现象现象结论结论改加改加1gKNO1gKNO33再加再加1gKNO1gKNO33加热加热再加再加1gKNO1gKNO33冷却冷却能全溶能全溶不能全溶不能全溶能全溶能全溶能全溶能全溶有固体析出有固体析出温度改变时,温度改变时,物质在水里物质在水里溶解性不相溶解性不相同。同。热的溶液冷却后,已溶解在溶液中的硝酸钾以晶体的热的溶液冷却后,已溶解在溶液中的硝酸钾以晶体的形式析出,这一过程叫形式析出,这一过程叫结晶结晶。。一、饱和溶液和不饱和溶液一、饱和溶液和不饱和溶液11、饱和溶液:、饱和溶液:一定温度一定温度下下一定量的溶剂一定量的溶剂中中不能再溶解不能再溶解某种某种物质的溶液物质的溶液22、不饱和溶液:、不饱和溶液:一定温度一定温度下下一定量的溶剂一定量的溶剂中中能继续溶解能继续溶解某种某种物质的溶液物质的溶液当温度确定、溶剂量确定时,某当温度确定、溶剂量确定时,某溶液的溶液的饱和状态饱和状态表示表示溶质溶质溶解的溶解的最大值。最大值。只有指明“在一定量溶剂里”和“在一定只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”温度下”,溶液的“饱和”和“不饱和”才有意义。才有意义。实验探究实验探究44KMnOKMnO44固体固体饱和食盐水饱和食盐水结论:结论:某种溶某种溶质的饱和溶液还质的饱和溶液还可能溶解其它物可能溶解其它物质。质。思考:饱和溶液和不饱和溶液怎样思考:饱和溶液和不饱和溶液怎样相互转化?相互转化?饱和溶液饱和溶液不饱和溶不饱和溶液液①①升高温度升高温度((通常情况通常情况下下))②②加入溶剂加入溶剂①①降低温度降低温度((通常情况下通常情况下))②②蒸发溶剂蒸发溶剂③③加入溶质加入溶质思考:如何判断一定条件下某溶液思考:如何判断一定条件下某溶液是否为饱和溶液?是否为饱和溶液?(1)(1)加少量溶质,看是否还能溶解;加少量溶质,看是否还能溶解;(3)(3)稍微降温,看是否有固体析出稍微降温,看是否有固体析出((通常情况下通常情况下))(2)(2)蒸发少量溶剂蒸发少量溶剂((温度不变温度不变)),看是,看是否否有固体析出;有固体析出;二、浓溶液和稀溶液二、浓溶液和稀溶液在一定量的溶液中,含溶质的量较在一定量的溶液中,含溶质的量较多的是浓溶液,含溶质的量较少的是稀溶液多的是浓溶液,含溶质的量较少的是稀溶液思考:思考:(1)(1)浓溶液是否一定为饱和溶液?稀溶液是否浓溶液是否一定为饱和溶液?稀溶液是否一定为不饱和溶液?一定为不饱和溶液?(2)(2)饱和溶液是否一定比不饱和溶液浓度大?饱和溶液是否一定比不饱和溶液浓度大?同种溶液,同一温度下可比较同种溶液,同一温度下可比较饱和饱和溶液溶液不饱和不饱和溶液溶液浓溶液浓溶液稀溶液稀溶液小结小结练习:练习:20℃20℃时,将时,将33g33g食盐加入食盐加入100g100g水中,水中,食盐全部溶解,此时溶液的质量为食盐全部溶解,此时溶液的质量为,再向此溶液中加入,再向此溶液中加入33gg食盐食盐又恰好全部溶解,则刚才的溶液为又恰好全部溶解,则刚才的溶液为溶液,现在溶液恰溶液,现在溶液恰好饱和,好饱和,溶液的质量为溶液的质量为,再向此,再向此溶液溶液中加入中加入3g3g食盐,溶液的质量为食盐,溶液的质量为。。11、物质的溶解性、物质的溶解性决定因素:决定因素:溶质和溶剂的性质溶质和溶剂的性质温度、压强等外温度、压强等外界条件界条件二、溶解度二、溶解度一种物质溶解在另一种物质溶解在另一种物质里的能力一种物质里的能力回忆:碘在水和汽油中溶解性的比较。NaClKNO3我溶解能力强,20℃时,50克水中最多可溶解18克。那有什么了不起,我10℃时,100克水中最多可溶解20.9克。哼!我才用了50克水,你呢!100克…我比你强!...