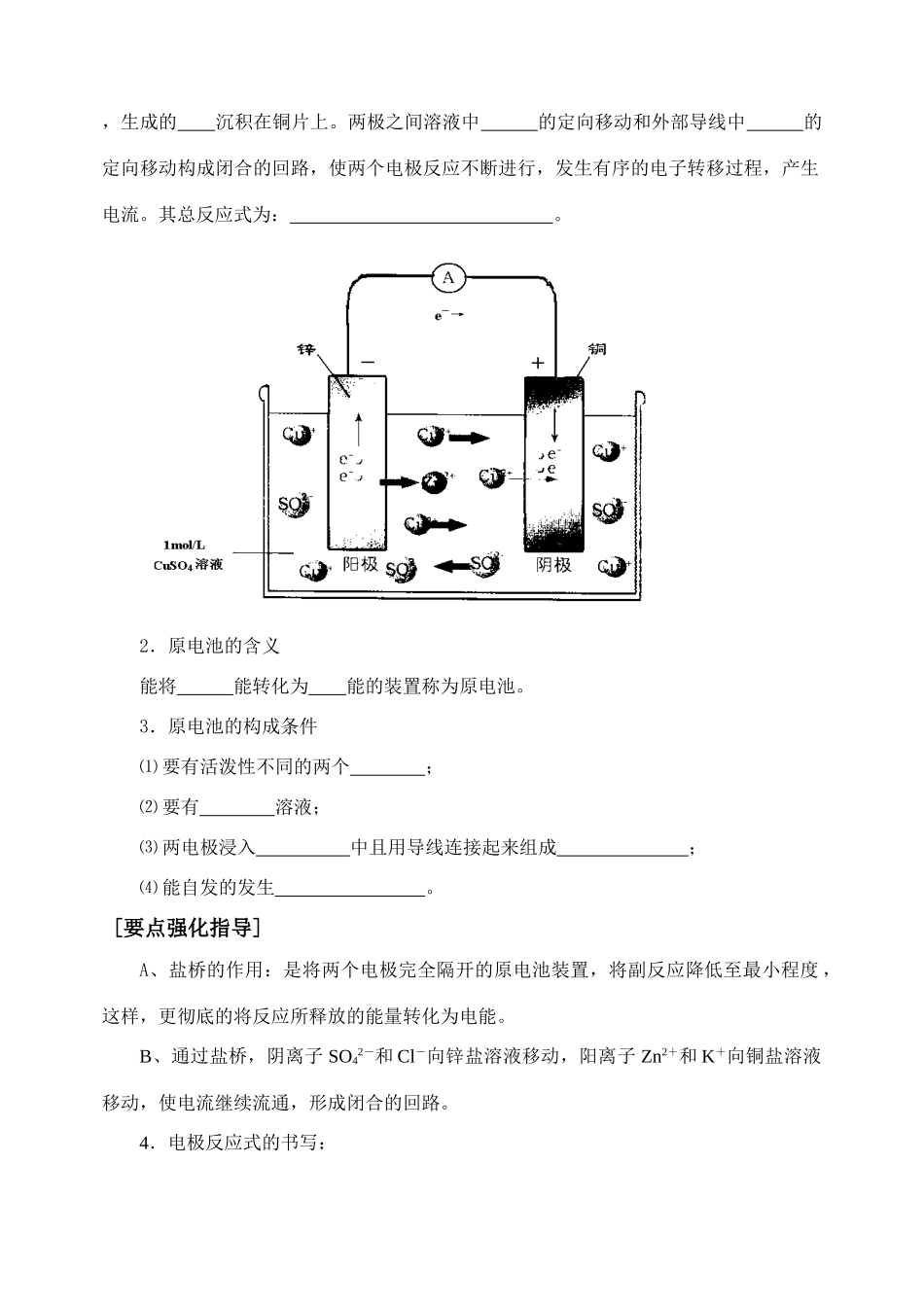
第三节化学能转化为电能——电池【课标三维定向】1.知识与技能⑴理解原电池的原理及其构成条件,掌握原电池的应用。⑵了解常见的化学电源。⑶理解并掌握金属的腐蚀和防护。2.过程与方法⑴通过动手实验,观察探索原电池的形成及原理,培养实验技能以及分析思维能力。⑵通过不断总结、发现、归纳知识的要点,培养学生的创造能力。3.情感态度与价值观通过学习电池的有关知识,感受化学给人类带来得进步和文明;了解废旧电池的回收知识,增强环保意识。【学习策略指导】学习重点:原电池的原理及其应用。学习难点:金属的腐蚀与防护。第一课时原电池的工作原理一、原电池的反应原理【自主学习】1.探究原电池的反应原理把铜片和锌片分别插入硫酸铜溶液中,在锌片上有析出,同时有放出,铜片上现象;用导线将铜片和锌片连接后,逐渐,质量逐渐增加;在铜片和锌片之间加上电流计(如下图所示),电流计的指针发生,说明有产生,即发生了能转化为能的过程。由电流的方向可知,电子由通过导线流向,由此判断是负极、是正极。锌片上有流出发生了反应,即:;锌原子电子通过导线流向,进入溶液,溶液中的在铜片上电子发生反应,即:,生成的沉积在铜片上。两极之间溶液中的定向移动和外部导线中的定向移动构成闭合的回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流。其总反应式为:。2.原电池的含义能将能转化为能的装置称为原电池。3.原电池的构成条件⑴要有活泼性不同的两个;⑵要有溶液;⑶两电极浸入中且用导线连接起来组成;⑷能自发的发生。[要点强化指导]A、盐桥的作用:是将两个电极完全隔开的原电池装置,将副反应降低至最小程度,这样,更彻底的将反应所释放的能量转化为电能。B、通过盐桥,阴离子SO42-和Cl-向锌盐溶液移动,阳离子Zn2+和K+向铜盐溶液移动,使电流继续流通,形成闭合的回路。4.电极反应式的书写:⑴原电池反应一般都是自发进行的,因而在写电极反应时,首先将总反应变换成反应(负极)和反应(正极)。如:2FeCl3+Cu=2FeCl2+CuCl2,正极:;负极:。其中,Fe电极为负极时,被氧化为离子。⑵正极反应与负极反应的得失电子数要。⑶正极反应与负极反应直接相加可得原电池的。⑷电极产物是否与电解质溶液中的有关成分作用,若有作用则要一块写出。⑸每个反应之前均须标明电极的属性。[要点强化指导]1.原电池是将化学能原转化为的热能而改转化为电能,并不是放热反应就能设计成原电池,而是能自发的氧化还原反应理论上可设计成原电池。2.电极材料有时并不一定是金属(如石墨碳棒),有时还可以是相同的金属(如金属铂),但电极反应一定是氧化还原反应。如:氢氧燃料电池。3.负极与电解质溶液的溶质不一定要求发生反应,但负极上一定有物质失去电子变成阳离子或消耗阴离子。【问题分析示例】例题1:如下图装置能组成原电池的是()[针对性练习]1.某电池的总反应的离子方程式为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是()正极负极电解质溶液A.CuFeFeCl3B.CFeFe(NO3)3C.FeZnFe2(SO4)3D.AgFeCuSO42.把铝片和镁片用导线连接成两组,分别依次插入到NaOH溶液、稀H2SO4溶液中,下列说法正确的是()A.都不能形成原电池B.负极材料依次为镁片、铝片C.负极材料依次为铝片、镁片D.负极材料都是镁片二、常见的化学电源【自主学习】1.常见的锌锰干电池⑴酸性锌锰干电池:作负极,作正极,是电解质溶液中的溶质,负极:,正极:,及H2+2MnO2=Mn2O3+H2O,4NH3+Zn2+=Zn[(NH3)4]2+;总反应式为:。⑵碱性锌锰干电池:作负极,作正极,是电解质溶液中的溶质,负极:,正极:;总反应式为:。[要点强化指导]酸性锌锰干电池中发生还原反应的物质有NH4+和MnO2,但电池正极得电子的是NH4+,MnO2是固体粉末,未与电解质溶液接触,其作用可理解为通过氧化还原反应吸收H2,使电池能持续工作。MnO2不能认为参与了电极反应。2.铅蓄电池铅蓄电池是二次电池,作负极,作正极,是电解质溶液,负极:,正极:;总反应式为:。[要点强化指导]二次电池在充电时是电解池,虽然作电池时正、负极上的反应与作电解池时阴、阳极上的反应相...