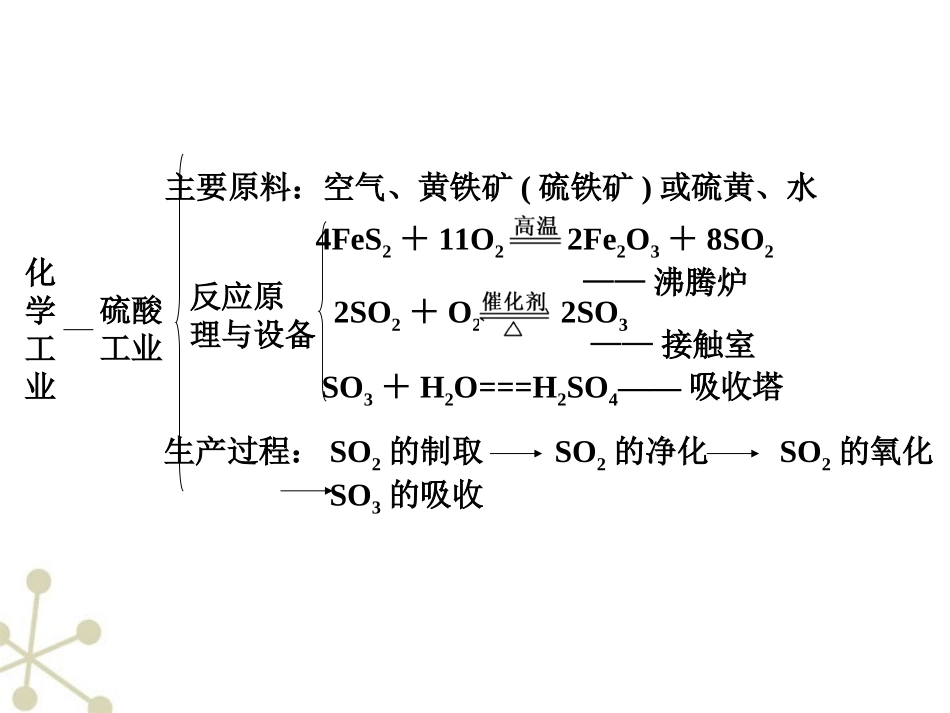
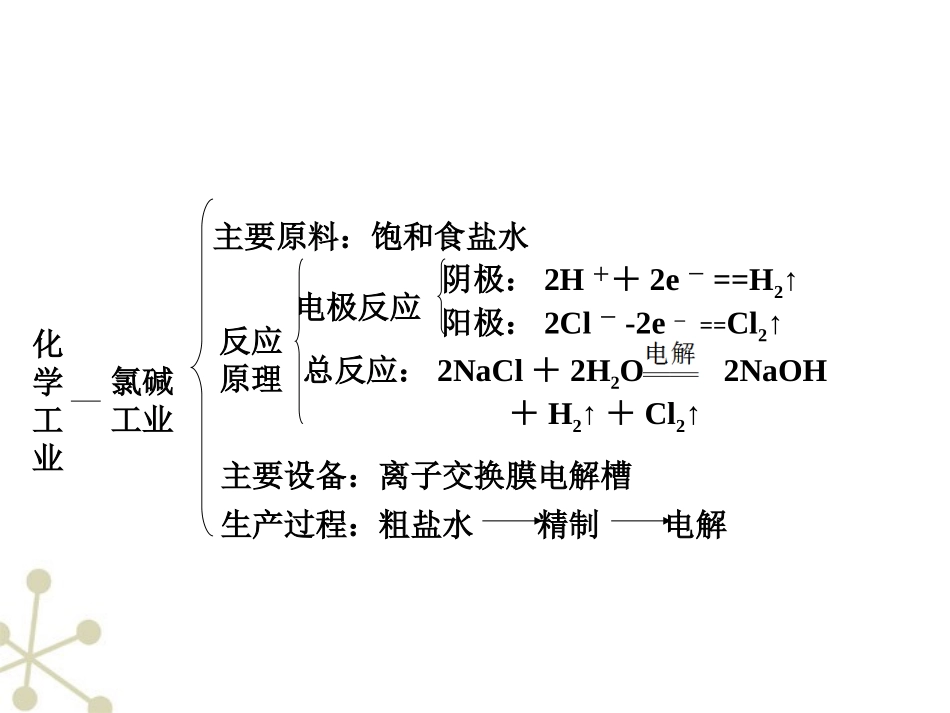
无机化工原理在考查方面的另外一个着力点是以全新的信息考查化学反应原理在合成氨、工业制H2SO4、氯碱工业上及无机非金属材料方面的应用。中学化学需要掌握的重要的化工生产原理如下:化学工业合成氨工业主要原料:空气、化石燃料、水反应原理C+H2O(g)CO+H2H2O(g)+COCO2+H2N2+3H22NH3主要设备:合成塔主要生产过程:原料气制备净化压缩合成分离第7讲化工工艺流程——非金属矿物加工及环境保护化学工业硫酸工业主要原料:空气、黄铁矿(硫铁矿)或硫黄、水反应原理与设备4FeS2+11O22Fe2O3+8SO2——沸腾炉——接触室2SO2+O22SO3SO3+H2O===H2SO4——吸收塔生产过程:SO2的制取SO2的净化SO2的氧化SO3的吸收化学工业氯碱工业主要原料:饱和食盐水反应原理电极反应阴极:2H++2e-==H2↑阳极:2Cl--2e-==Cl2↑总反应:2NaCl+2H2O2NaOH+H2↑+Cl2↑主要设备:离子交换膜电解槽生产过程:粗盐水精制电解化学工业玻璃工业主要原料:石灰石、石英、纯碱反应原理CaCO3+SiO2CaSiO3+CO2↑Na2CO3+SiO2Na2SiO3+CO2↑主要成分:Na2O·CaO·6SiO2解题策略解此类型题目的基本步骤是:①从题干中获取有用信息,了解生产的产品。②分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么,B.发生了什么反应,C.该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为了获得产品。③从问题中获取信息,帮助解题,了解流程后着手答题。对反应条件的分析可从以下几个方面着手:对反应速率有何影响、对平衡转化率有何影响、对综合生产效益有何影响(如可以从原料成本是否廉价,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护等方面考虑)。热点1含氯化合物的加工技术例1亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;③HClO2可看成是强酸。(1)160g/LNaOH溶液的物质的量浓度为________,若要计算该溶液溶质的质量分数,还需要的一个条件是_______。(2)在发生器中鼓入空气的作用可能是________(填序号)。A.将SO2氧化成SO3,增强酸性B.稀释ClO2以防止爆炸C.将NaClO3氧化成ClO2(3)吸收塔内的反应的化学方程式为____________,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:_________________________。(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是________________________。(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是________(填序号)。A.Na2O2B.Na2SC.FeCl2D.PbO(悬浊液)(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________(填序号)。A.蒸馏B.蒸发C.灼烧D.过滤E.冷却结晶要得到更纯的NaClO2·3H2O晶体必须进行的操作是________(填操作名称)。解析(1)160g/LNaOH溶液表示的是1L溶液中含有NaOH的质量是160g,NaOH的物质的量是4mol,所以此溶液的物质的量浓度是4mol·L-1,若要计算该溶液溶质的质量分数,需要知道溶液的质量,所以还需要的条件是溶液的密度。(2)根据题给信息,纯ClO2易分解爆炸,由此可判断发生器中鼓入空气的作用是稀释ClO2以防止爆炸。(3)通过吸收塔内的反应制备NaClO2,ClO2是氧化剂,H2O2是还原剂,相应的氧化产物应是氧气,同时参加反应的还有NaOH,此反应的化学方程式应为:2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2;H2O2分解的化学方程式为2H2O2=====△2H2O+O2↑。(4)判断NaOH是否过量可以采用测定溶液pH的方法。(5)本实验的目的是制备纯净的亚氯酸钠(NaClO2),制备过程中选取的还原剂不能引入杂质,H2O2相应的产物是H2O和氧气,没有引入杂质。分析选项,Na2O2相应的产物是NaOH和氧气,不会引入杂质,PbO(悬浊液)相应的产物是PbO2固体,过滤可以除去。B、C都会引入杂质。(6)从滤液中得到粗晶体的步骤是蒸发、冷却结晶...