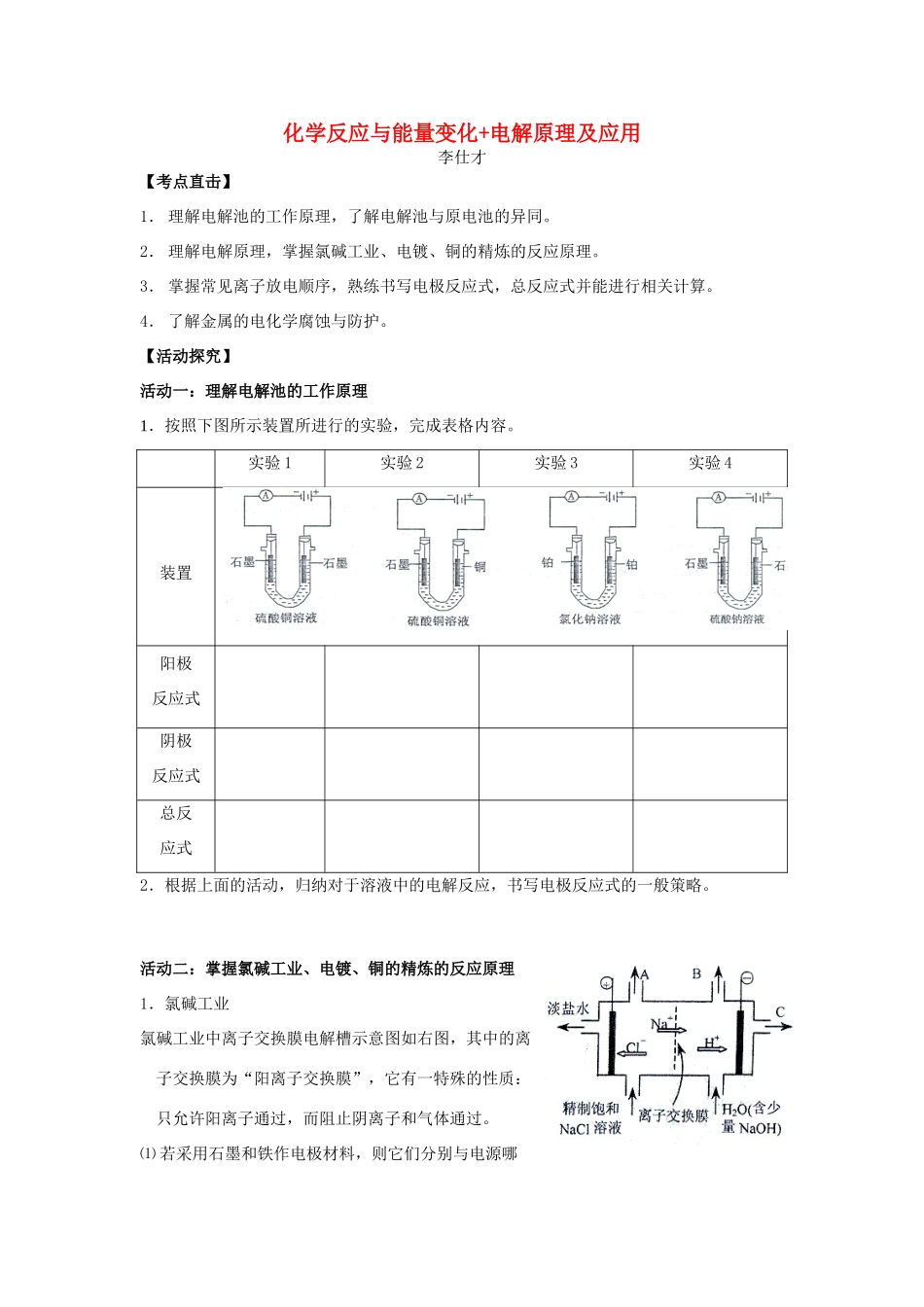
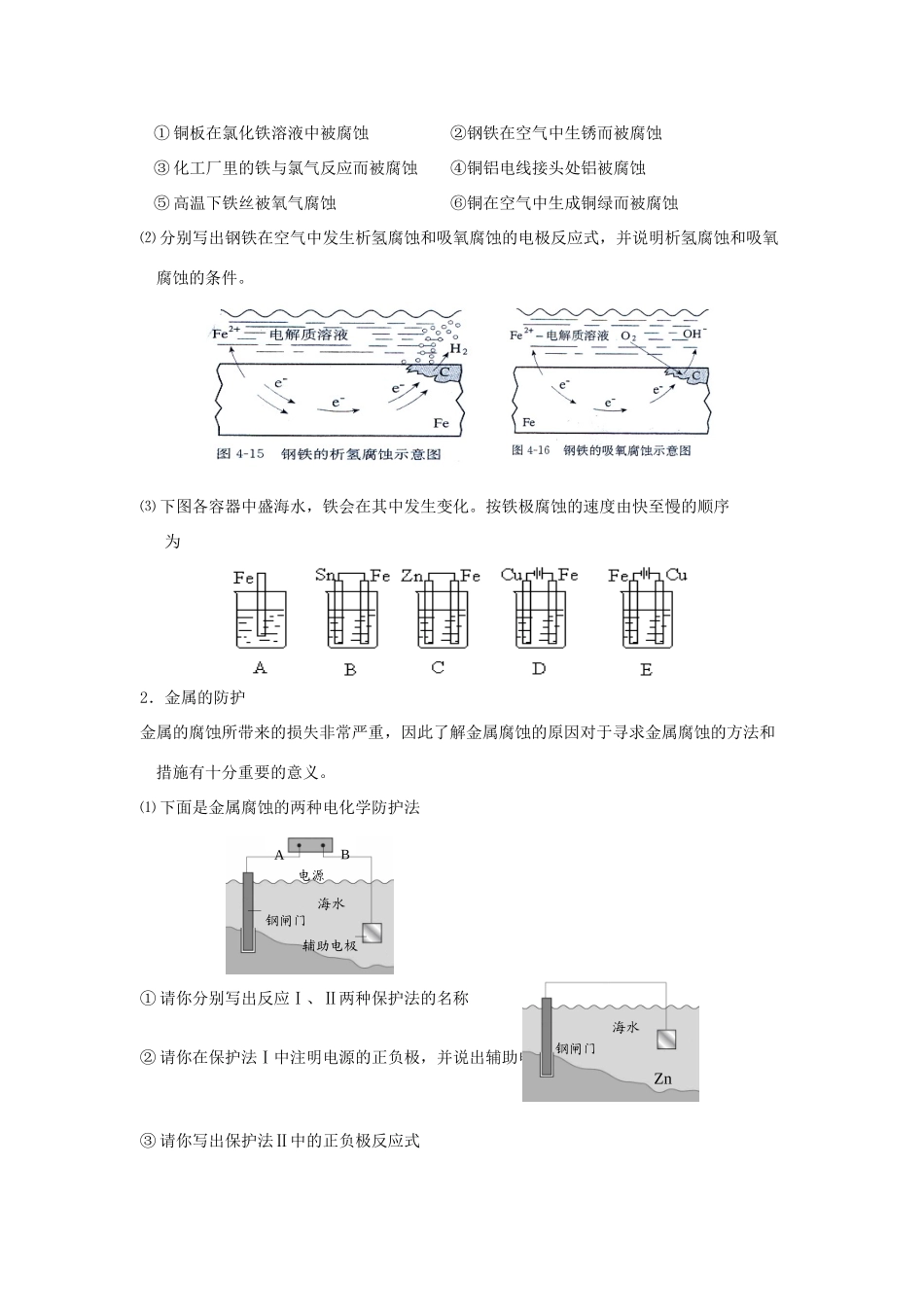
化学反应与能量变化+电解原理及应用李仕才【考点直击】1.理解电解池的工作原理,了解电解池与原电池的异同。2.理解电解原理,掌握氯碱工业、电镀、铜的精炼的反应原理。3.掌握常见离子放电顺序,熟练书写电极反应式,总反应式并能进行相关计算。4.了解金属的电化学腐蚀与防护。【活动探究】活动一:理解电解池的工作原理1.按照下图所示装置所进行的实验,完成表格内容。实验1实验2实验3实验4装置阳极反应式阴极反应式总反应式2.根据上面的活动,归纳对于溶液中的电解反应,书写电极反应式的一般策略。活动二:掌握氯碱工业、电镀、铜的精炼的反应原理1.氯碱工业氯碱工业中离子交换膜电解槽示意图如右图,其中的离子交换膜为“阳离子交换膜”,它有一特殊的性质:只允许阳离子通过,而阻止阴离子和气体通过。⑴若采用石墨和铁作电极材料,则它们分别与电源哪个极相连?⑵向阴极区加入的不是纯水而是含少量NaOH的水,你认为它的作用是什么?⑶分别写出电极反应式和总反应的离子方程式2.电镀右下图为实验室在金属钥匙表面镀银的工作示意图,据此回答下列问题:⑴a、b分别是电源的什么极?电解质溶液是什么?⑵写出该电镀过程的电极反应式⑶电镀过程中,某物理量y的理论变化曲线如图所示,你认为y可以表示哪些物理量?3.铜的精炼⑴画出精炼粗铜的简易工作示意图,并在图中标出电极材料、电解质溶液。⑵若粗铜中含有锌、银等杂质,写出铜的精炼过程中,两极发生的电极反应式。⑶电解过程中电解质溶液中的Cu2+浓度如何变化?⑷若粗铜中含有锌、铁、银、铂等杂质,电解后,电解槽底部的阳极泥中有。活动三:了解金属的电化学腐蚀与防护1.金属的腐蚀⑴金属的腐蚀可分为化学腐蚀和电化学腐蚀。判断下列腐蚀哪些是化学腐蚀,哪些是电化学腐蚀?①铜板在氯化铁溶液中被腐蚀②钢铁在空气中生锈而被腐蚀③化工厂里的铁与氯气反应而被腐蚀④铜铝电线接头处铝被腐蚀⑤高温下铁丝被氧气腐蚀⑥铜在空气中生成铜绿而被腐蚀⑵分别写出钢铁在空气中发生析氢腐蚀和吸氧腐蚀的电极反应式,并说明析氢腐蚀和吸氧腐蚀的条件。⑶下图各容器中盛海水,铁会在其中发生变化。按铁极腐蚀的速度由快至慢的顺序为2.金属的防护金属的腐蚀所带来的损失非常严重,因此了解金属腐蚀的原因对于寻求金属腐蚀的方法和措施有十分重要的意义。⑴下面是金属腐蚀的两种电化学防护法①请你分别写出反应Ⅰ、Ⅱ两种保护法的名称②请你在保护法Ⅰ中注明电源的正负极,并说出辅助电极可以用什么材料③请你写出保护法Ⅱ中的正负极反应式海水钢闸门Zn海水电源AB钢闸门辅助电极⑵再列举一些其他的金属防腐蚀的方法【课堂反馈】1.用石墨作电极电解CuSO4溶液。通电一段时间后,欲使电解质溶液恢复到起始状态,应向溶液中加入适量的A.CuSO4B.H2OC.CuOD.CuSO4·5H2O2.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2有关该电池的说法正确的是A.充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2OB.充电过程是化学能转变为电能的过程C.放电时负极附近溶液的碱性不变D.放电时电解质溶液中的OH-向正极移动3.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2OCu2O+H2↑。下列说法正确的是A.铜电极发生还原反应B.石墨电极上产生氢气C.铜电极接直流电源的负极D.当有0.1mol电子转移时,有0.1molCu2O生成。4.某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是()A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-Cl2↑+H2↑B.断开K2,闭合K1时,石墨电极附近溶液变红C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-===2Cl-D.断开K1,闭合K2时,石墨电极作正极5.下图所示装置中,甲、乙、丙三个烧杯依次盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。⑴接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%...