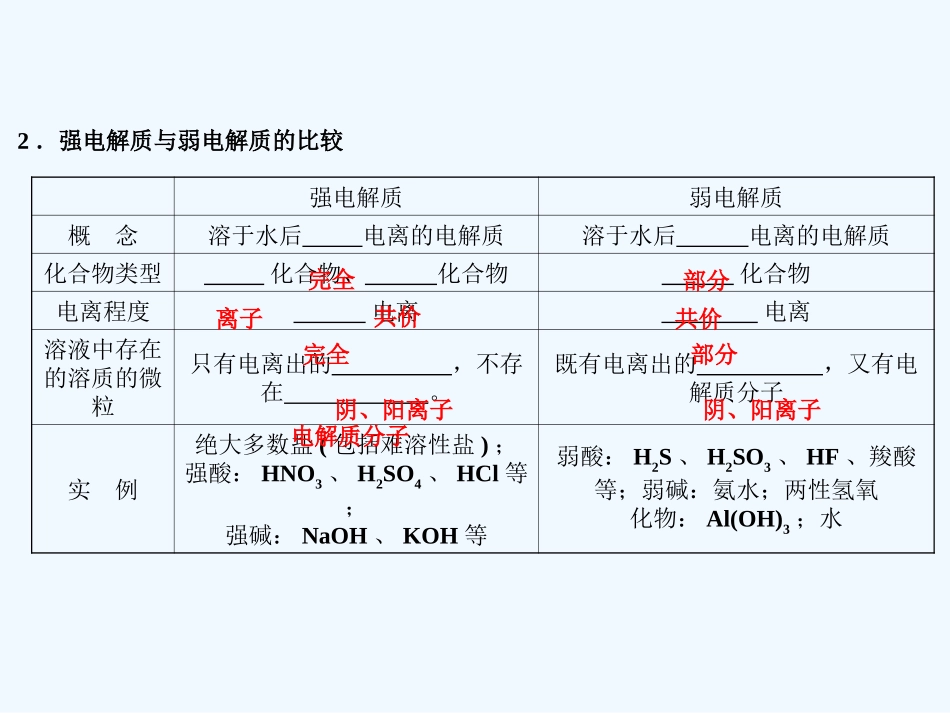
1.了解电解质、非电解质、强电解质、弱电解质的概念,并能进行判断。2.了解电解质的电离,能够书写电离方程式。3.了解离子反应的概念,掌握离子反应发生的条件。4.掌握离子反应方程式的书写方法。5.能够判断离子方程式的正误和离子共存问题。第二节电解质和离子反应1.电解质与非电解质(1)电解质:在下能够导电的叫做电解质。(2)非电解质:在下都不导电的化合物叫做非电解质。水溶液里或熔融状态化合物水溶液和熔融状态强电解质弱电解质概念溶于水后电离的电解质溶于水后电离的电解质化合物类型化合物、化合物化合物电离程度电离电离溶液中存在的溶质的微粒只有电离出的,不存在。既有电离出的,又有电解质分子实例绝大多数盐(包括难溶性盐);强酸:HNO3、H2SO4、HCl等;强碱:NaOH、KOH等弱酸:H2S、H2SO3、HF、羧酸等;弱碱:氨水;两性氢氧化物:Al(OH)3;水2.强电解质与弱电解质的比较完全离子共价完全阴、阳离子电解质分子部分共价部分阴、阳离子【想一想】1.CO2溶于水,水溶液能导电,CO2是电解质吗?答:判断化合物是不是电解质,溶液的导电性仅仅是一个条件,关键要看是不是化合物本身能够电离出自由移动的离子,CO2的水溶液导电是由于CO2和水化合生成的H2CO3电离出自由移动的离子,而不是CO2电离出的,故CO2不是电解质。2.食盐晶体不导电,那么氯化钠是电解质吗?答:食盐(氯化钠)是由钠离子和氯离子构成的化合物,在固态时不导电,但在水溶液中或熔融状态下能导电,所以氯化钠是电解质,判断时应根据电解质的概念。1.离子反应是指,主要包括和的氧化还原反应。2.离子方程式是用来表示离子反应的式子,书写的具体步骤是“一写”、“二改”、“三删”、“四查”,与化学方程式相比较,离子方程式可表示反应。例如:H++OH-===H2O,就表示强酸和强碱反应生成可溶性盐和水的反应。有离子参加的反应复分解反应有离子参加实际参加反应的离子符号一类【想一想】判断下列几个反应是否属于离子反应,为什么?1.加热KClO3和MnO2的混合物制氧气。答:不是,因为不是在水溶液中进行的离子反应。2.铜和浓硫酸反应。答:不是,浓硫酸以分子形式参与反应,没有自由移动的离子。3.二氧化锰和浓盐酸加热制氯气。答:是。4.氨气和氯化氢相遇产生白烟。答:不是,氨气和氯化氢是分子间反应,无离子参加。【例1】下列说法中正确的是()A.两种溶液中,导电能力较强的就是强电解质B.稀H2SO4是电解质溶液C.固体硫酸钡不导电,它是非电解质D.两种溶液中,溶质的量越多,导电能力越强解析:溶液导电能力的强弱主要决定于溶液中自由移动的离子浓度及离子所带的电荷数,与电解质强弱无关。答案:B(1)在水溶液里或熔融状态下这两个条件,只要满足其中之一即可判断某化合物为电解质。(2)电解质的强弱是由物质内部结构决定的,与任何外界因素无关。(3)电解质的强弱与其溶解性无关。某些盐如BaSO4、CaCO3等虽然难溶于水,但溶于水的部分却是完全电离的,所以它们是强电解质;相反,能溶于水的未必都是强电解质,如CH3COOH、NH3·H2O等虽然能溶于水,但溶解时只有部分电离,故这些是弱电解质。通常以选择题型来考查,一般紧扣概念即可解决。1.下列物质的水溶液能导电但属于非电解质的是()A.CH3COOHB.Cl2C.NH4HCO3D.SO2解析:选项中四种物质的水溶液均能导电,是否属于非电解质,要按非电解质的定义判断,电解质、非电解质的范畴是化合物,B是单质,不符合题意;SO2水溶液虽能导电,是因为SO2与水反应生成H2SO3,H2SO3电离出H+和使溶液导电,而不是SO2直接电离出导电离子。答案:D2.下列描述正确的是()A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质C.可通过溶液导电能力的大小判断强弱电解质D.在NaHSO4溶液中存在的离子有:Na+、H+、、OH-解析:A项中纯碱是Na2CO3属于盐;C项溶液导电能力的大小取决于溶液中离子浓度大小与电解质强弱无关;D项中NaHSO4的电离方程式为:NaHSO4===Na++H++,故溶液中不存在。答案:B3.下列关于电解质电离的叙述中正确的是()A.CaCO3在水中的溶解度很小,其溶液的电阻率很...