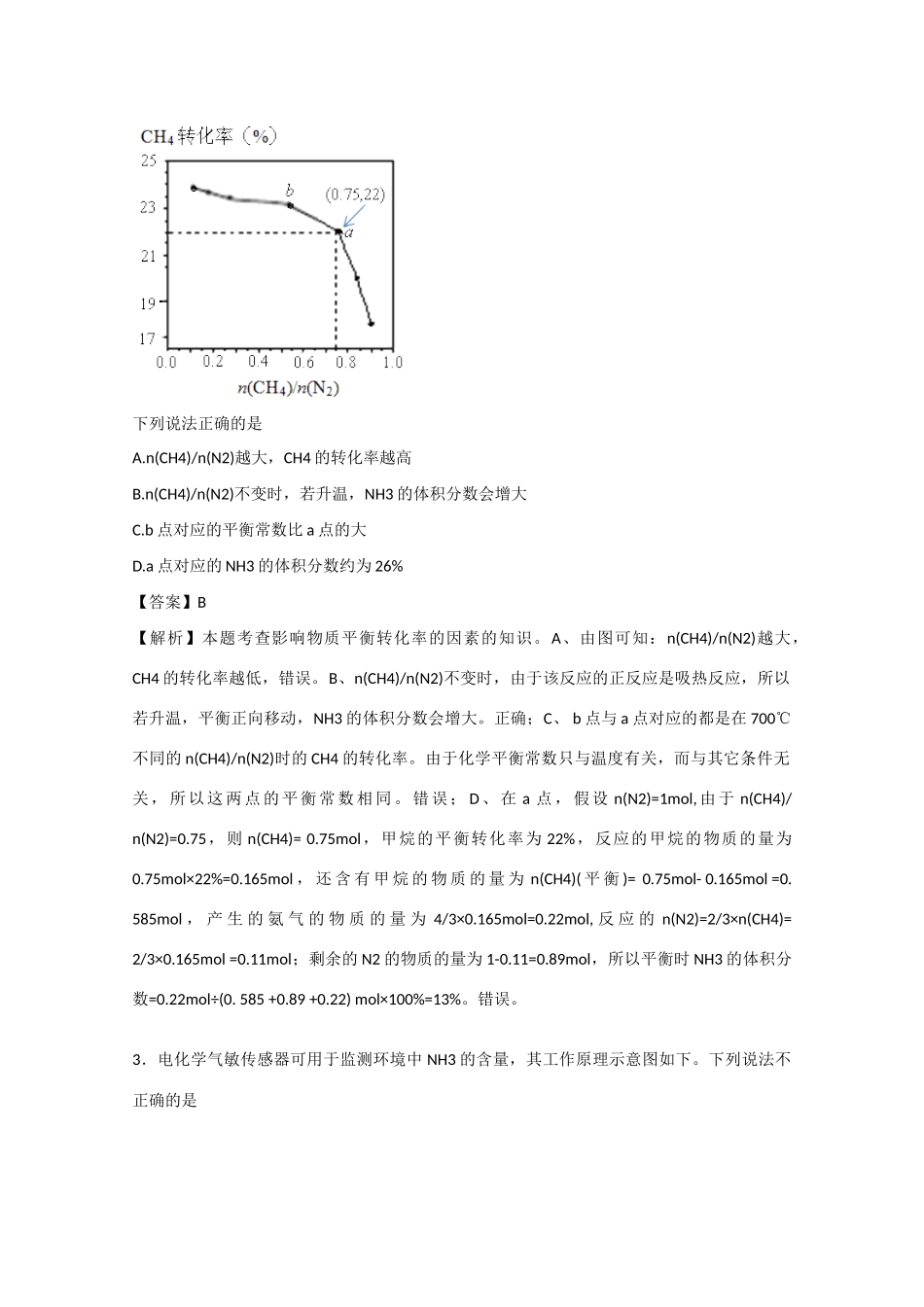
上海市松江区2015届高三4月模拟练习理科综合化学试卷考试时间:90分钟;满分:100分注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上第I卷(选择题)一、单选题:共7题每题6分共42分1.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。则关于“暖冰”的判断正确的是A.“暖冰”中存在离子键B.“暖冰”中水分子的O—H键是非极性键C.“暖冰”的密度大,有导电性和导热性D.水凝固形成20℃时的“暖冰”所发生的变化是物理变化【答案】D【解析】本题考查关于“暖冰”的判断的知识。A、“暖冰”中的水仍然是以分子的形式存在。在分子内存在共价键,不存在离子键。错误;B、“暖冰”中水分子的O-H键是不同元素形成的极性键,错误;C、“暖冰”由于形成时温度高,所以分子间的间隔大,所以密度小。错误;D、水凝固形成20℃时的“暖冰”由于没有产生新的物质,所以所发生的变化是物理变化。正确。所以选D。2.已知:3CH4(g)+2N2(g)3C(s)+4NH3(g)ΔH>0,在700℃,CH4与N2在不同物质的量之比时CH4的平衡转化率如下图所示:下列说法正确的是A.n(CH4)/n(N2)越大,CH4的转化率越高B.n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大C.b点对应的平衡常数比a点的大D.a点对应的NH3的体积分数约为26%【答案】B【解析】本题考查影响物质平衡转化率的因素的知识。A、由图可知:n(CH4)/n(N2)越大,CH4的转化率越低,错误。B、n(CH4)/n(N2)不变时,由于该反应的正反应是吸热反应,所以若升温,平衡正向移动,NH3的体积分数会增大。正确;C、b点与a点对应的都是在700℃不同的n(CH4)/n(N2)时的CH4的转化率。由于化学平衡常数只与温度有关,而与其它条件无关,所以这两点的平衡常数相同。错误;D、在a点,假设n(N2)=1mol,由于n(CH4)/n(N2)=0.75,则n(CH4)=0.75mol,甲烷的平衡转化率为22%,反应的甲烷的物质的量为0.75mol×22%=0.165mol,还含有甲烷的物质的量为n(CH4)(平衡)=0.75mol-0.165mol=0.585mol,产生的氨气的物质的量为4/3×0.165mol=0.22mol,反应的n(N2)=2/3×n(CH4)=2/3×0.165mol=0.11mol;剩余的N2的物质的量为1-0.11=0.89mol,所以平衡时NH3的体积分数=0.22mol÷(0.585+0.89+0.22)mol×100%=13%。错误。3.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是A.O2在电极b上发生还原反应B.溶液中向电极a移动C.反应消耗的NH3与O2的物质的量之比为4:5D.负极的电极反应式为:2NH3-6+6N2+6H2O【答案】C【解析】本题考查原电池原理。构成的原电池中,通入氧气的电极是正极,发生还原反应,A正确;溶液中阴离子氢氧根离子移向负极a极,B正确;1molNH3反应生成氮气转移3mol电子,1molO2反应转移电子4mol,根据电子转移守恒,消耗的NH3与O2的物质的量之比为4:3,C错误;负极的电极反应式为:2NH3-6+6N2+6H2O,D正确,故选C。4.在一定条件下发生反应3A(g)+2B(g)zC(g)+2D(g),在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L–1·min–1。则下列说法不正确的是A.z=4B.B的转化率是40%C.A的平衡浓度是1.4mol·L-1D.平衡时气体压强是原来的【答案】D【解析】本题考查化学平衡的计算,熟悉化学平衡的三段法及转化率的计算即可解答。根据反应速率之比等于化学计量数之比,来确定化学计量数z。vD=0.2mol/(L•min),vC=0.4mol/(L•min),则z=4;,计算可知z=4,故A正确;B的转化率×100%=40%,故B正确;A的平衡浓度==1.4mol/L,故C正确;气体物质的量之比等于压强之比,平衡时气体压强是原来的,故D错误;故选D。5.煤的气化是煤高效、洁净利用的方向之一。如图所示为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图。由图可知该煤气中A.只含有碳、氢两种元素B.所含的有机物是CH4、CnHm、COC.CO体积分数小于CH4体积分数D.氢气体积分数最大【答案】C【解析】A项错误,明显组成上含有O;B项错误,CO不属于有机物;D项错误,在高于600℃时H2的体积分数才最大。6.大自然几乎把99%的溴都存放在海洋中。在海水的综合利用中,...