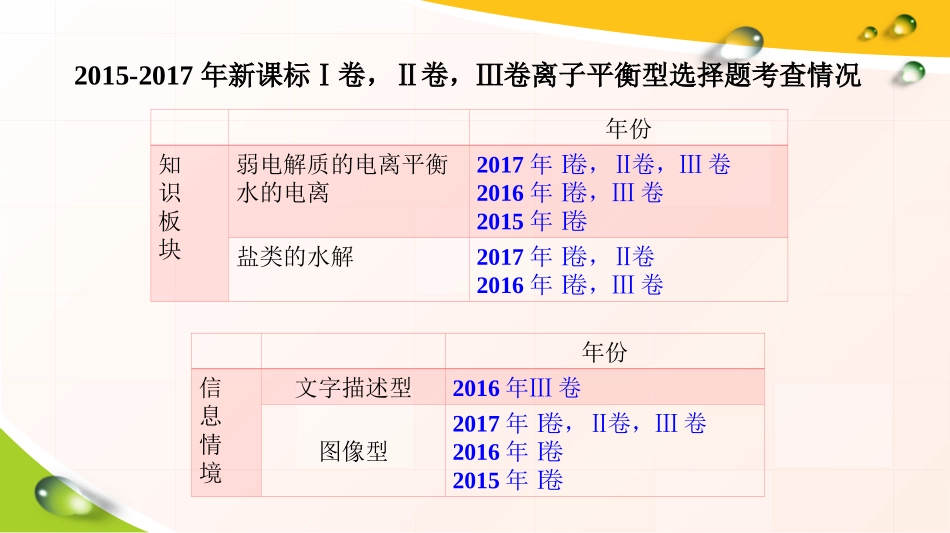
汕头金中倪冬冰离子平衡型选择题的突破——以信息情境解决问题离子平衡型选择题的突破——以信息情境解决问题2015-2017年新课标Ⅰ卷,Ⅱ卷,Ⅲ卷离子平衡型选择题考查情况年份知识板块弱电解质的电离平衡水的电离2017年Ⅰ卷,Ⅱ卷,Ⅲ卷2016年Ⅰ卷,Ⅲ卷2015年Ⅰ卷盐类的水解2017年Ⅰ卷,Ⅱ卷2016年Ⅰ卷,Ⅲ卷年份信息情境文字描述型2016年Ⅲ卷图像型2017年Ⅰ卷,Ⅱ卷,Ⅲ卷2016年Ⅰ卷2015年Ⅰ卷一、文字描述型例1:下列有关电解质溶液的叙述错误的是B.常温下,0.1mol·L-1pH为9的NaHB溶液中:c(Na+)>c(HB-)>c(OH-)>c(H2B)>c(B2-)A.CH3COOH溶液中:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)单一溶质的溶液弱酸、弱碱:盐含弱离子的正盐:弱酸酸式盐:电离平衡水解平衡考虑酸式酸根以电离为主还是水解为主一、文字描述型例1:下列有关电解质溶液的叙述错误的是C.0.01mol/L的盐酸与0.01mol/L的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O)>c(OH-)D.常温下0.4mol/LCH3COOH溶液和0.2mol/LNaOH溶液等体积混合后溶液显酸性,则溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)D混合溶液相互反应相互不反应恰好完全反应不是恰好完全反应确定溶质的组成比较溶液平衡的主次总结:分析情境—确定溶质组成—分析溶液中平衡的主次常温下,Ka(HCOOH)=1.77×10−4,Ka(CH3COOH)=1.75×10−5,Kb(NH3·H2O)=1.75×10−5,下列说法正确的是变式训练1:BA.0.2mol/LHCOOH与0.1mol/LNaOH等体积混合后的溶液中:c(HCOO−)+c(OH−)=c(HCOOH)+c(H+)B.0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后的溶液中(pH<7):c(CH3COO−)>c(Cl−)>c(CH3COOH)>c(H+)C.浓度均为0.1mol/L的HCOONa和CH3COONa混合溶液中:c(Na+)>c(CH3COO−)>c(HCOO−)>c(OH−)>c(H+)D.CH3COONH4溶液为中性,存在c(CH3COO−)=c(NH4+)=c(OH−)=c(H+)例1.常温下用0.1mol/LNaOH溶液滴定20.00mL0.1mol/LCH3COOH溶液,滴定曲线如下图,已知0.1mol/LCH3COOH的电离度为1%,下列有关叙述错误的是二、图像型A.A点pH值为32c(H+)-c(CH3COOH)=2c(OH-)-c(CH3COO-)C.C点存在以下关系c(Na+)=c(CH3COO-)>c(OH-)=c(H+)D.D点存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+)BB.B点存在以下关系:电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH)++①若D点pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol/L②D点:c(CH3COO-)+c(CH3COOH)=0.1mol/L③D点:c(OH-)=c(H+)+c(CH3COOH)④滴定过程中存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+)②改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-物质的量分数δ(X)随pH的变化如图所示【已知】22(X)(X)(HA)(HA)(A)cccc下列叙述错误的是A.pH=1.2时,2(HA)(HA)cc22lg[(HA)]4.2KD.B.pH=2.7时,22(HA)(HA)(A)cccC.pH=4.2时,2(HA)(A)(H)cccC变式训练1:1.通过已知图像比较粒子浓度大小2.通过交点计算电离常数H2AHA-A2-分析草酸溶液中pH=3时,三种粒子浓度大小比较H2AH++HA-HA-H++A2-磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH反应获得。常温下溶液中的H3PO4、H2PO4-、HPO42-、PO43-物质的量分数δ(X)随pH的变化如图所示。计算Ka1(H3PO4)、Ka2(H3PO4)、Ka3(H3PO4)。变式训练2:变式训练3:常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液pH与离子浓度变化的关系如图所示。下列叙述错误的是D.当混合溶液呈中性时,2(Na)(HX)(X)(OH)(H)cccccDA.Ka2(H2X)的数量级为10–62(HX)lg(HX)ccB.曲线N表示pH与的变化关系(H)(OH)ccC.NaHX溶液中(0,4.4)(0,5.4)HX-电离程度HX-水解程度Na2XNaHX迁移应用:将左图转化为以pH值为横坐标,溶液中的H2X、HX-、X2-物质的量分数δ(X)为纵坐标,溶液中的H2X、HX-、X2-物质的量分数δ(X)随pH的变化的趋势图。(提示:找出关键点,画出H2X、HX-、X2-的变化趋势即可,不需要算出δ(X))变式训练1NaOH加到二元弱酸溶液中变式训练3将左图转化为以pH值为横坐标,溶液中的H2X、HX-、X2-物质的量分数δ(X)为纵坐标,溶液中的H2X、HX-、X2-物质的量分数δ(X)随pH的变化的趋势图。(提示:找出关键点,画出H2X、HX-、X2-的变化趋势即可,不需要算出δ(X))H2XHX-X2-离子平衡型选择题的突破信息情境特点突破方式文字描述型静态的,固定的确定溶质组成,分析平衡主次关系图像型动态的,多变的分析情境,明确横纵坐标,有效读图,寻找关键点分析情境—确定溶质组成—分析溶液中平衡的主次谢谢大家!