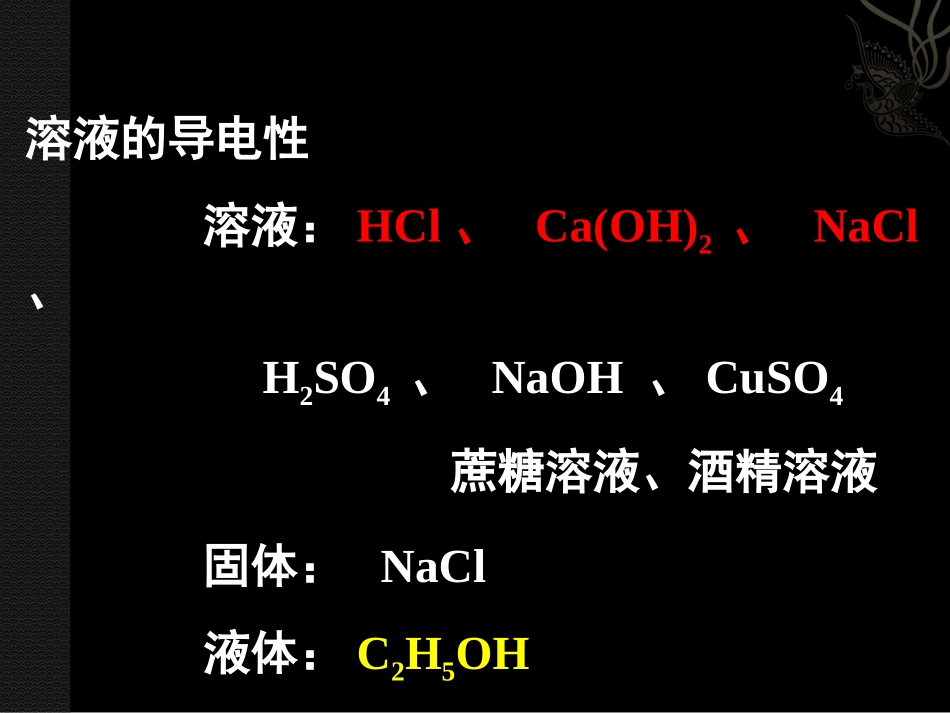
溶液的导电性溶液:HCl、Ca(OH)2、NaCl、H2SO4、NaOH、CuSO4蔗糖溶液、酒精溶液固体:NaCl液体:C2H5OH现象:酸、碱、盐溶液能导电;蔗糖溶液、酒精溶液、纯C2H5OH不导电;NaCl固体不导电。原因:酸、碱、盐溶液能导电蔗糖和酒精溶液、纯C2H5OH不导电NaCl固体不导电------有自由移动的阴、阳离子------以分子形式存在---有阴、阳离子,但不能自由移动酸碱盐的水溶液能导电,因为存在大量自由移动的离子。酸的电离HCl=H++Cl-HNO3=H++NO3-H2SO4=2H++SO42-酸根:带电的原子或原子团定义:电离时生成的阳离子全部是氢离子的化合物。NaHSO4=Na++H++SO42-(酸式盐)碱:电离出的阴离子全部是氢氧根离子(OH-)的化合物。NaOH=KOH=Ca(OH)2=Ba(OH)2=Na++OH-K++OH-Ca2++2OH-Ba2++2OH-本节课重点:酸=氢离子(H+)+酸根离子碱=金属阳离子+氢氧根离子(OH¯)