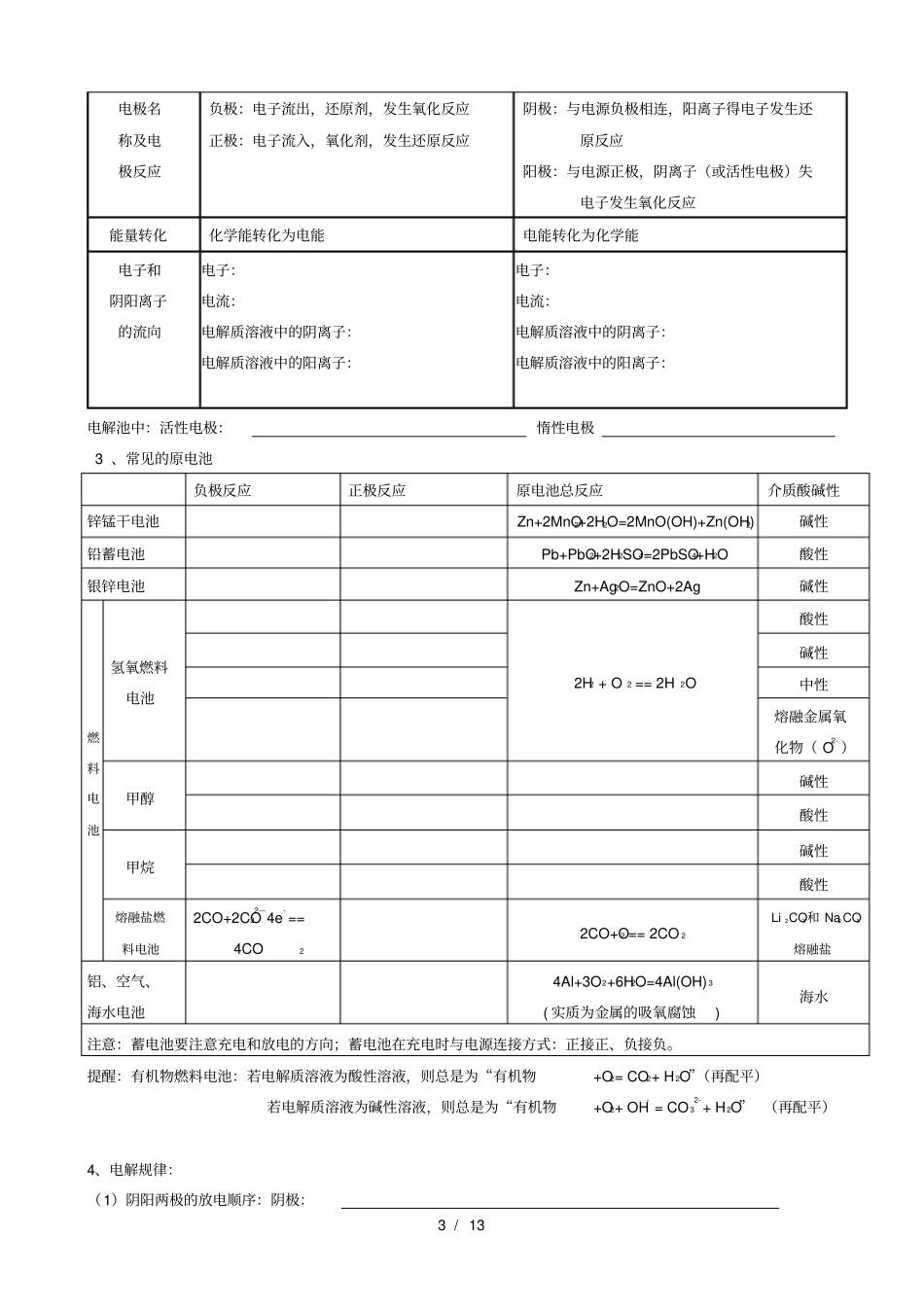
1 / 13 专题一:化学反应与能量变化一、反应热、焓变1.反应热:化学反应过程中放出或吸收 的热量,叫反应热。包括燃烧热和中和热。电离:注意:水解:吸热反应的发生不一定需要常见的吸热反应:铵盐与碱的反应:如NH4Cl 与 Ba(OH)2?8H2O 加热才能进行。大多数的分解反应:CaCO3== CaO + CO2生产水煤气: C + H 2O == CO+H2碳和二氧化碳的反应:C+CO2=2CO 燃烧反应金属与酸(或水)的反应常见的放热反应:酸碱中和反应自发的氧化还原反应 CaO(Na2O、Na2O2)与水的反应浓酸与强碱溶于水2、焓变:在恒温恒压的条件下,化学反应过程中吸收或放出的热量称为反应的焓变。符号:用ΔH表示单位: kJ/mol 放热反应:ΔH= — QkJ/mol ;或Δ H<0 吸热反应:ΔH= +QkJ/mol ;或Δ H>0 3、反应热产生的原因:宏观:反应物和生成物所具有的能量不同,ΔH=_____________________________ 微观:化学反应过程中化学键断裂吸收的能量与新化学键生成所放出的能量不同,ΔH=____________ 二、热化学方程式1. 热化学方程式的概念:能表示反应热的化学方程式,叫做热化学方程式。热化学方程式不仅表示了化学反应中的物质变化,也表明了化学反应中的能量变化。2. 书写热化学方程式时的注意点(1)需注明 Δ H的“+”与“—”,“ +”表示,“—”表示;比较 Δ H的大小时,要考虑Δ H的正负。(3)要注明反应物和生成物的状态:g、 l 、 s、aq ( 3)各物质前的化学计量数表示物质的量,不表示分子个数,因此,可以是整数也可以是分数,但系数与 Δ H的值一定要相对应。(4)要注明反应温度和压强,但中学化学中所用Δ H的数据一般都是在101kPa 和 25℃时的数据,因此可不特别注明;(5)对于可逆反应,其Δ H同样要与系数相对应,但若按系数投料反应,则由于可逆反应不能进行完全,其反应热的数值会比Δ H的数值要小。三、 燃烧热、热值与中和热:1.燃烧热:在 1atm下, 1mol物质完全燃烧的反应热叫做该物质的标准燃烧热。(物质完全燃烧是指含有注意:放热反应不一定常温下就自发进行,可能需要加热或点燃条件。2 / 13 的氮元素转化为N2(g),氢元素转化为H2O(l) ,碳元素转化为CO2(g) 2、热值:在 1atm下, 1g物质完全燃烧的反应热叫做该物质的热值。(糖类、脂肪、蛋白质中热值最高的是脂肪)3、中和热:是指在稀溶液中的强酸和强碱反应生成1mol水时(无沉淀或气体生成)的反应热。H+(aq) + OH-...