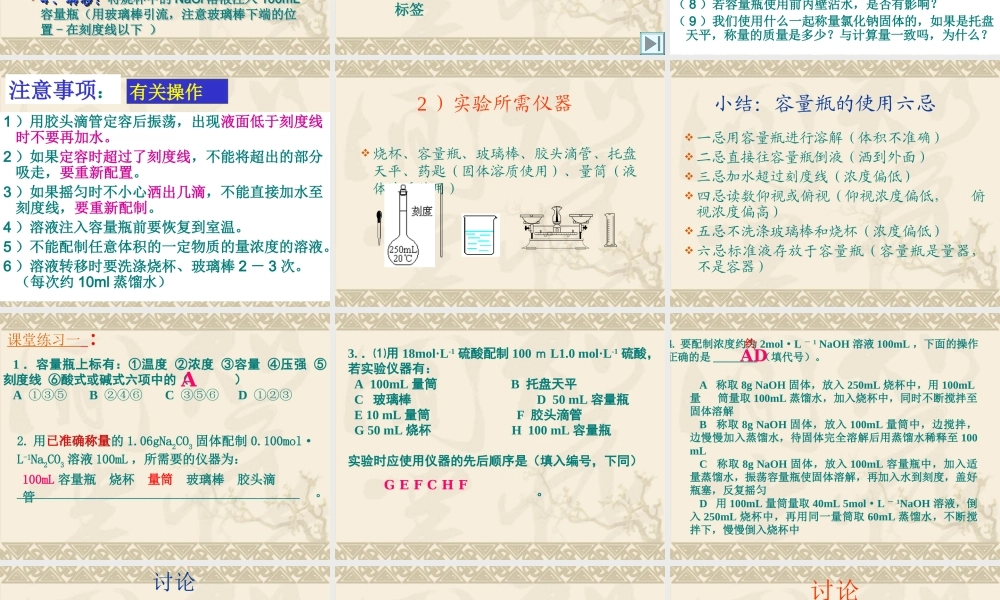
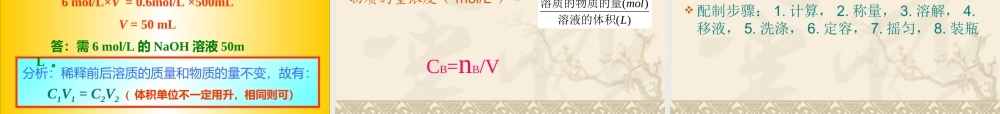三、物质的量在化学实验中的应用本节课要求 1 、正确理解和掌握物质的量浓度的概念,学会有关物质的量浓度的计算 . 2 、学会配制一定物质的量浓度的溶液。 锡场中学 王春燕 2009.9.25 1 、物质的量浓度 含义:单位体积溶液里所含溶质 B 的物质的量,称为 B 的物质的量浓度。 符号 CB 单位 mol/L 。 表达式:物质的量浓度( mol/L ) = )()(Lmol溶液的体积溶质的物质的量CB=nB/V 说明 (1)B 表示各种溶质。 (2) 在组成上是指溶液和溶质,不是溶剂和溶质。 (3) 在物理量上,溶液用的是体积,溶质用的是物质的量。注意,溶剂体积一般不等于溶液体积,溶剂体积 + 溶质体积≠溶液体积。 (4) 从某溶液取出任意的溶液,其物质的量浓度都相同,但所含溶质的物质的量因体积不同而不同。 ( 溶液是均一、稳定的。 ) (5) 物质的量浓度符号是 CB ,单位是:摩尔 / 升 (mol/L 或 mol·L-1) ?图中问号处缺少的是哪个操作的图?问: 2 、一定物质的量浓度的溶液的配制1 )步骤 以配置 100mL1.00mol/L 的氯化钠溶液为例 11 、计算:、计算: NaCl 的质量 n(NaCl)=1.00mol/L×0.1L=0.1molm(NaCl)=0.1mol×58.5g/mol=5.85 克 22 、称量:、称量:(复习天平的使用) 33 、溶解:、溶解:在烧杯中用 30-50 毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解) 44 、转移:、转移:将烧杯中的 NaCl 溶液注入 100mL容量瓶(用玻璃棒引流,注意玻璃棒下端的位置 - 在刻度线以下 ) 以配置 100mL1.00mol/L 的氯化钠溶液为例 11 、计算:、计算: NaCl 的质量 n(NaCl)=1.00mol/L×0.1L=0.1molm(NaCl)=0.1mol×58.5g/mol=5.85 克 22 、称量:、称量:(复习天平的使用) 33 、溶解:、溶解:在烧杯中用 30-50 毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解) 44 、转移:、转移:将烧杯中的 NaCl 溶液注入 100mL容量瓶(用玻璃棒引流,注意玻璃棒下端的位置 - 在刻度线以下 ) 5 、洗涤:洗涤烧杯 2~3 次(每次用 10mL 左右的水)66 、定容:、定容:向容量瓶中加蒸馏水,加水到接近刻度线 1~2 厘米时,改用胶头滴管加水至液面与刻度线相切。7 、摇匀:反复摇匀 8 、装瓶、贴标签 :装入试剂瓶并贴上标签 步骤: 思考与交流:( 1 )若定容后振荡发现体积小于刻度,能否再加水到刻度?...