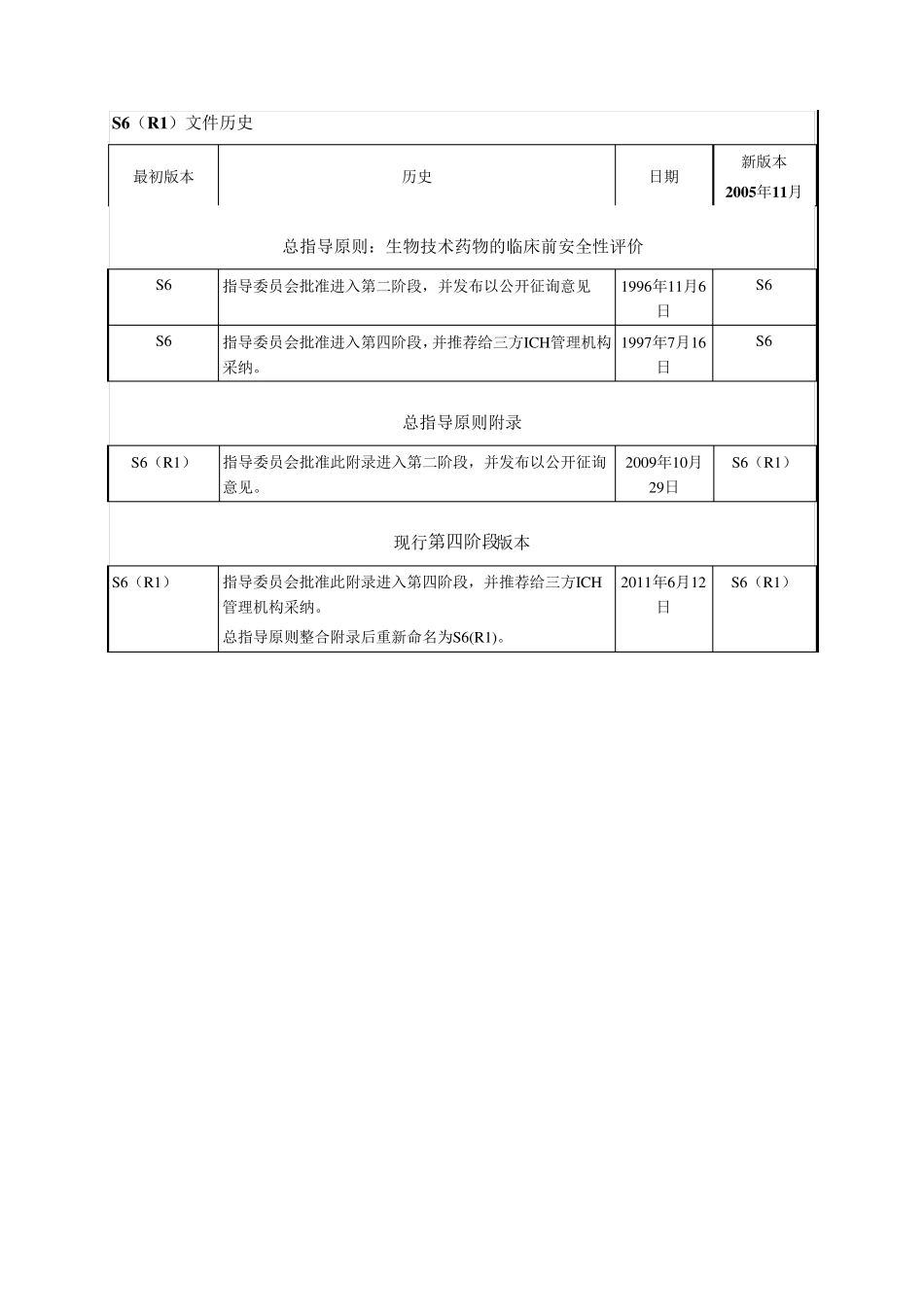
人用药品注册技术要求国际协调会 ICH 三方协调指导原则 生物技术药物的临床前安全性评价 S6(R1) 1 9 9 7 年7 月1 6 日总指导原则 现行第四阶段版本 2 0 1 1 年6 月底整合2 0 1 1 年6 月1 2 日的附录 本指导原则由相应的ICH专家小组制定,按照ICH进程,已递交管理部门讨论。在ICH进程第四阶段,最终草案被推荐给欧盟、日本和美国的管理机构采纳。 S6(R1)文件历史 最初版本 历史 日期 新版本 2005年11月 总指导原则:生物技术药物的临床前安全性评价 S6 指导委员会批准进入第二阶段,并发布以公开征询意见 1996年11月6日 S6 S6 指导委员会批准进入第四阶段,并推荐给三方ICH管理机构采纳。 1997年7月16日 S6 总指导原则附录 S6(R1) 指导委员会批准此附录进入第二阶段,并发布以公开征询意见。 2009年10月29日 S6(R1) 现行第四阶段版本 S6(R1) 指导委员会批准此附录进入第四阶段,并推荐给三方ICH管理机构采纳。 总指导原则整合附录后重新命名为S6(R1)。 2011年6月12日 S6(R1) i 生物技术药物的临床前安全性评价 ICH三方协调指导原则 目录 第I部分: ............................................................................................................................................... 1 1. 前言 ................................................................................................................................................. 1 1.1 背景 ..................................................................................................................................... 1 1.2 目的 ..................................................................................................................................... 1 1.3 范围 ..................................................................................................................................... 1 2. 受试物的质量标准 ......................................................................................................................... 2 3. 临床前安全性试验 ............................................................................................................................