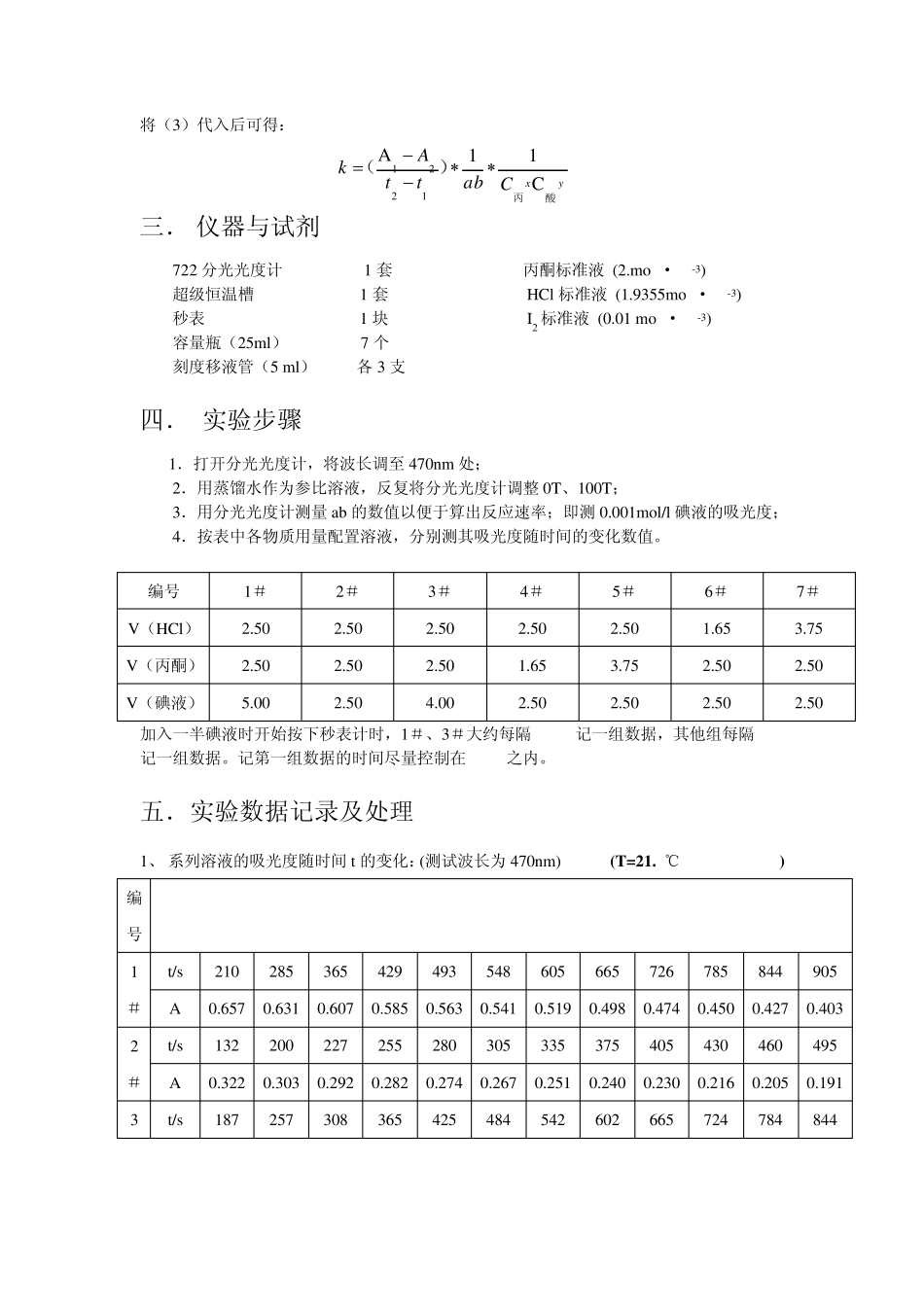
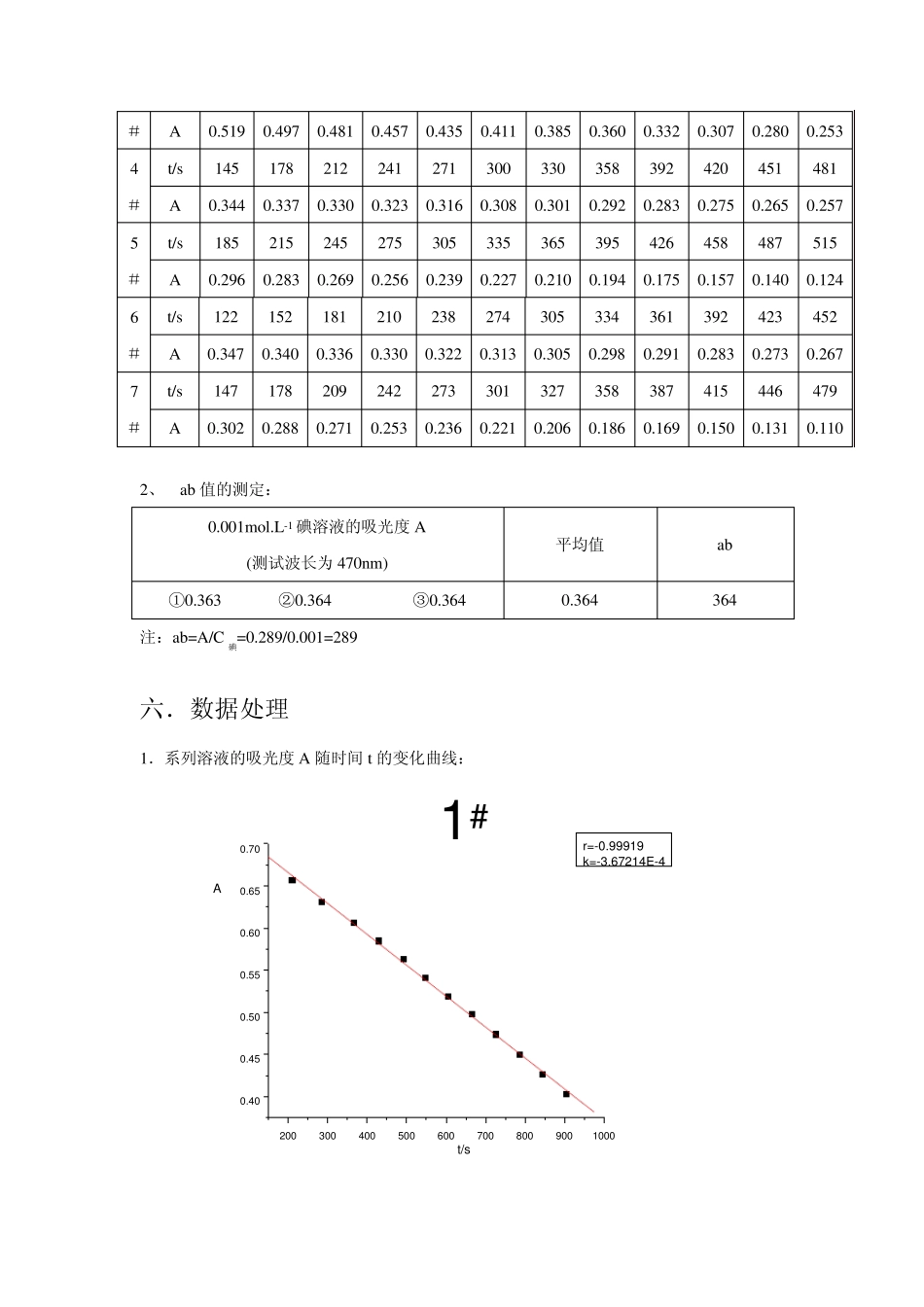
实验五 丙酮碘化反应的速率方程 一. 实验目的 1. 掌握用孤立法确定反应级数的方法; 2. 测定酸催化作用下丙酮碘化反应的速率常数; 3. 通过本实验加深对复杂反应特征的理解。 二. 实验原理 孤立法,即设计一系列溶液,其中只有某一种物质的浓度不同,而其他物质的浓度均相同,借此可以求得反应对该物质的级数。同样亦可得到各种作用物的级数,从而确立速率方程。 丙酮碘化是一个复杂反应,其反应式为 CH3COCH3+I2CH3CCH2IO+ H++ I-H+ 设丙酮碘化反应速率方程式为: zIyHCLxCOCHCHICCkCdtdC2332 (1) 式中 k 为反应速率常数,指数 x、y、z分别为丙酮,酸和碘的反应级数。将该式取对数后可得: 2332lglglglglgIHCLOCHCHICzCyCxkdtdC (2) 在上述三种物质中,固定其中两种物质的浓度,配置第三种物质浓度不同的一系列溶液,则反应速率只是该物质浓度的函数。以 lg(-dC碘/dt)对该组分浓度的对数作图,所得直线即为该物质在此反应中的反应级数。同理,可得其他两个物质的反应级数。 碘在可见光区有很宽的吸收带,可用分光光度计测定反应过程中碘浓度随时间变化 的关系。按照比尔定律可得: 20lglgAIabCIIT (3) 式中 A 为吸光度,T 为透光率,I 和 I0 分别为某一特定波长的光线通过待测溶液和空白溶液后的光强,a 为吸光系数,b 为样品池光径长度,以 A 对时间 t 作图,斜率为 ab(-dC碘/dt).测得 a 和 b,可算出反应速率。 若C丙酮≈CHCl﹥﹥C碘 ,发现 A对 t作图后得一直线。显然只有在(-dC碘/dt)不随时间改变时才成立,意味着反应速率与碘的浓度无关,从而得知该反应对碘的级数为零。 当控制碘为变量时,反应过程中可认为丙酮和盐酸的浓度不变,又因为 z 为 0,则由(2)积分可得: )(酸丙碘碘12yx21tCCtkCC 将(3)代入后可得: yxCabttAk酸丙)(C11A1221 三. 仪器与试剂 722 分光光度计 1 套 丙酮标准液 (2.mol·dm-3) 超级恒温槽 1 套 HCl 标准液 (1.9355mol·dm-3) 秒表 1 块 I2 标准液 (0.01 mol·dm-3) 容量瓶(25ml) 7 个 刻度移液管(5 ml) 各 3 支 四. 实验步骤 1.打开分光光度计,将波长调至 470nm 处; 2.用蒸馏水作为参比溶液,反复将分光光度计调整 0T、100T; 3.用分光光度计测量 ab 的数值以便于算出反应速率;即测 0.001mol/l...