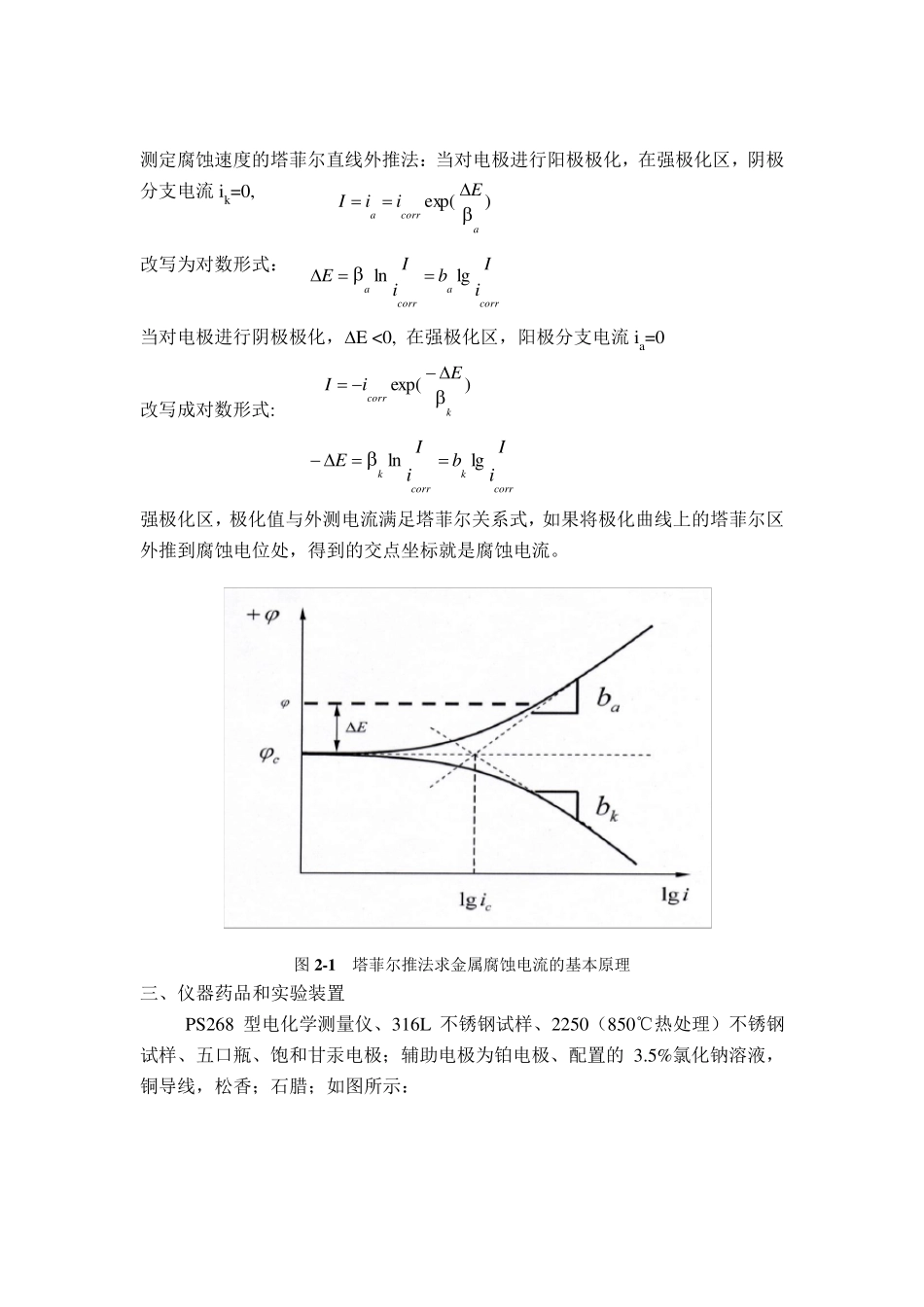
极化曲线对金属腐蚀特性的研究 一、目的和要求 1、 掌握恒电位法测定电极极化曲线的原理和实验技术; 2、 通过测定 316L 不锈钢和 2250(850℃热处理)不锈钢在 3.5% NaCl 溶液中的极化曲线,测出不锈钢的自腐蚀电位,比较不锈钢在腐蚀溶液中的腐蚀特性; 3、 掌握极化曲线对金属腐蚀特性的分析方法。 二、基本原理 当金属浸于腐蚀介质时,如果金属的平衡电极电位低于介质中去极化剂(如H+或氧分子)的平衡电极电位,则金属和介质构成一个腐蚀体系,称为共轭体系。此时,金属发生阳极溶解,去极化剂发生还原。在本实验中,不锈钢与NaCl 溶液构成腐蚀体系。 钢与 NaCl 溶液构成腐蚀体系的电化学反应式为: 阳极: Fe= Fe 2++2e 阴极: 2H2O+2e=H2+2OH- 腐蚀体系进行电化学反应时的阳极反应的电流密度以 ia 表示, 阴极反应的速度以 ik 表示, 当体系达到稳定时,即金属处于自腐蚀状态时,ia=ik=icorr(icorr为腐蚀电流),体系不会有净的电流积累,体系处于一稳定电位c 。根据法拉第定律,即在电解过程中,阴极上还原物质析出的量与所通过的电流强度和通电时间成正比,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。因此求得金属腐蚀电流即代表了金属的腐蚀速度。金属处于自腐蚀状态时,外测电流为零。 极化电位与极化电流或极化电流密度之间的关系曲线称为极化曲线。测量腐蚀体系的阴阳极极化曲线可以揭示腐蚀的控制因素及缓蚀剂的作用机理。在腐蚀点位附近积弱极化区的举行集会测量可以可以快速求得腐蚀速度。在活化极化控制下,金属腐蚀速度的一般方程式为: 其中 I 为外测电流密度,ia 为金属阳极溶解的速度,ik 为去极化剂还原的速度,βa、βk 分别为金属阳极溶解的自然对数塔菲尔斜率和去极化剂还原的自然对数塔菲尔斜率。 这就是腐蚀金属电极的极化曲线方程式,令 令∆E 称为腐蚀金属电极的极化值,∆E=0 时,I=0;∆E>0 时,是阳极极化,I>0,体系通过阳极电流。∆E<0 时,I<0, 体系通过的是阴极电流,此时是对腐蚀金属电极进行阴极极化。因此外测电流密度也称为极化电流密度 )]exp()[exp(kcaccorrkaiiiIcE )]exp()[exp(kacorrEEiI 测定腐蚀速度的塔菲尔直线外推法:当对电极进行阳极极化,在强极化区,阴极分支电流ik=0, 改写为对数形式: 当对电极进行阴极极化,...