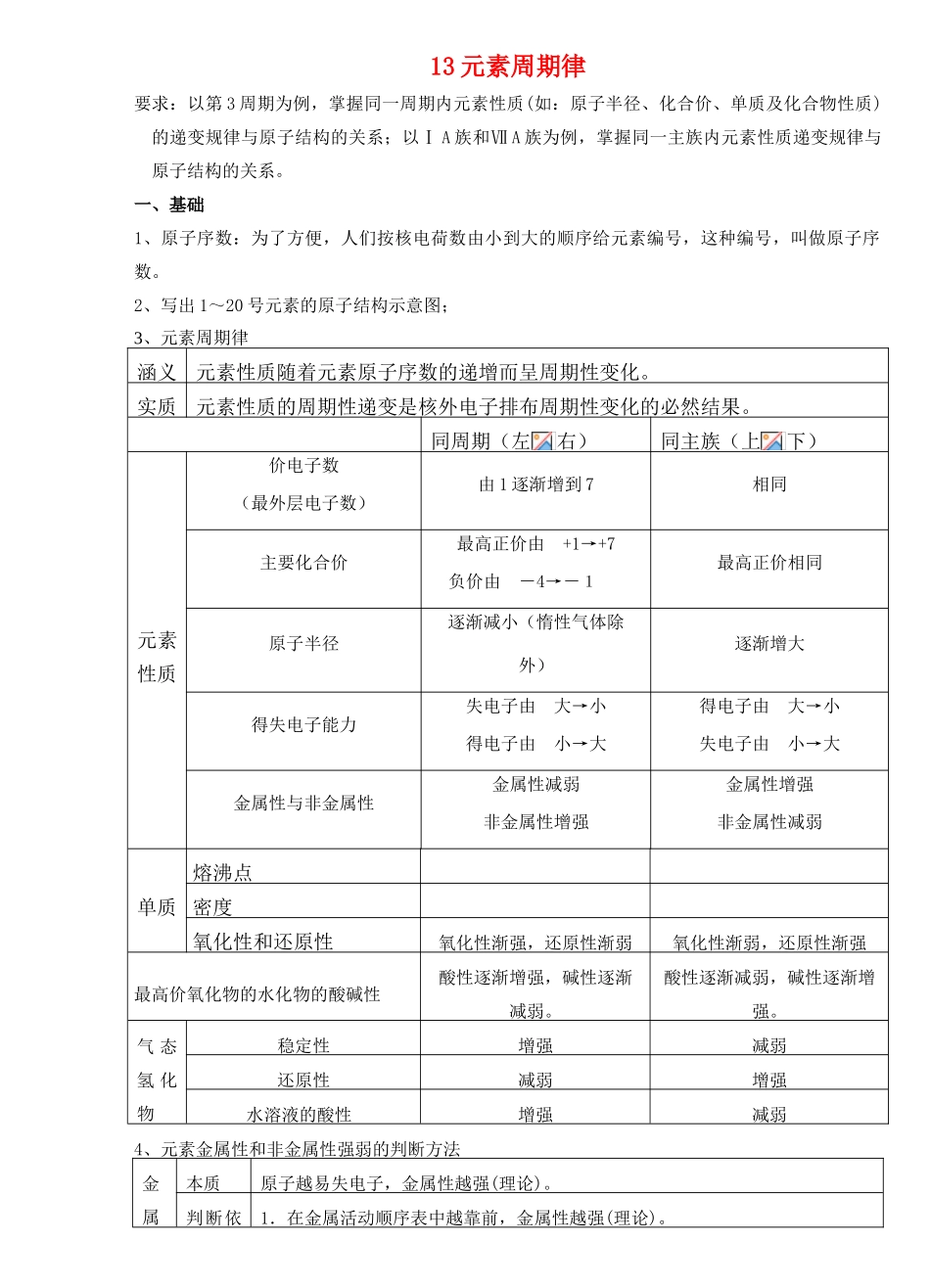
13 元素周期律要求:以第 3 周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以Ⅰ A 族和Ⅶ A 族为例,掌握同一主族内元素性质递变规律与原子结构的关系。一、基础1、原子序数:为了方便,人们按核电荷数由小到大的顺序给元素编号,这种编号,叫做原子序数。2、写出 1~20 号元素的原子结构示意图;3、元素周期律涵义元素性质随着元素原子序数的递增而呈周期性变化。实质元素性质的周期性递变是核外电子排布周期性变化的必然结果。同周期(左右)同主族(上下)元素性质价电子数(最外层电子数)由 1 逐渐增到 7相同主要化合价最高正价由 +1→+7负价由 -4→-1最高正价相同原子半径逐渐减小(惰性气体除外)逐渐增大得失电子能力失电子由 大→小得电子由 小→大得电子由 大→小失电子由 小→大金属性与非金属性金属性减弱非金属性增强金属性增强非金属性减弱单质熔沸点密度氧化性和还原性氧化性渐强,还原性渐弱氧化性渐弱,还原性渐强最高价氧化物的水化物的酸碱性酸性逐渐增强,碱性逐渐减弱。酸性逐渐减弱,碱性逐渐增强。气 态氢 化物稳定性增强减弱还原性减弱增强水溶液的酸性增强减弱4、元素金属性和非金属性强弱的判断方法金属本质原子越易失电子,金属性越强(理论)。判断依1.在金属活动顺序表中越靠前,金属性越强(理论)。性比较据2.同一周期从左到右金属性减弱,同一主族从上到下金属性增强(理论)。3.单质与水或非氧化性酸反应越剧烈,金属性越强(事实)。4.单质还原性越强或离子氧化性越弱(电解时在阴极上得电子的先后),金属性越强(事实)。5.最高价氧化物对应水化物的碱性越强,金属性越强(事实)。6. 若 xn++yx+ym+ 则 y 比 x 金属性强(事实)。7.原电池反应中正负极非金属性比较本质原子越易得电子,非金属性越强(理论)。判断方法1.同一周期从左到右非金属性增强,同一主族从上到下非金属性减弱(理论)。2.与 H2化合越易,气态氢化物越稳定,非金属性越强(事实)。3.单质氧化性越强,阴离子还原性越弱,非金属性越强(事实)。 4.最高价氧化物的水化物酸性越强,非金属性越强(事实)。5.An-+BBm-+A 则 B 比 A 非金属性强(事实)。6.与同一还原剂反应,根据反应的难易、产物的化合价等判断。二、注意点1、不同价态的同种元素与其氢氧化物酸碱性的关;变价元素氧化物对应水化物的酸性与价态有关,价态越低其对应水化物的酸性越弱,碱...