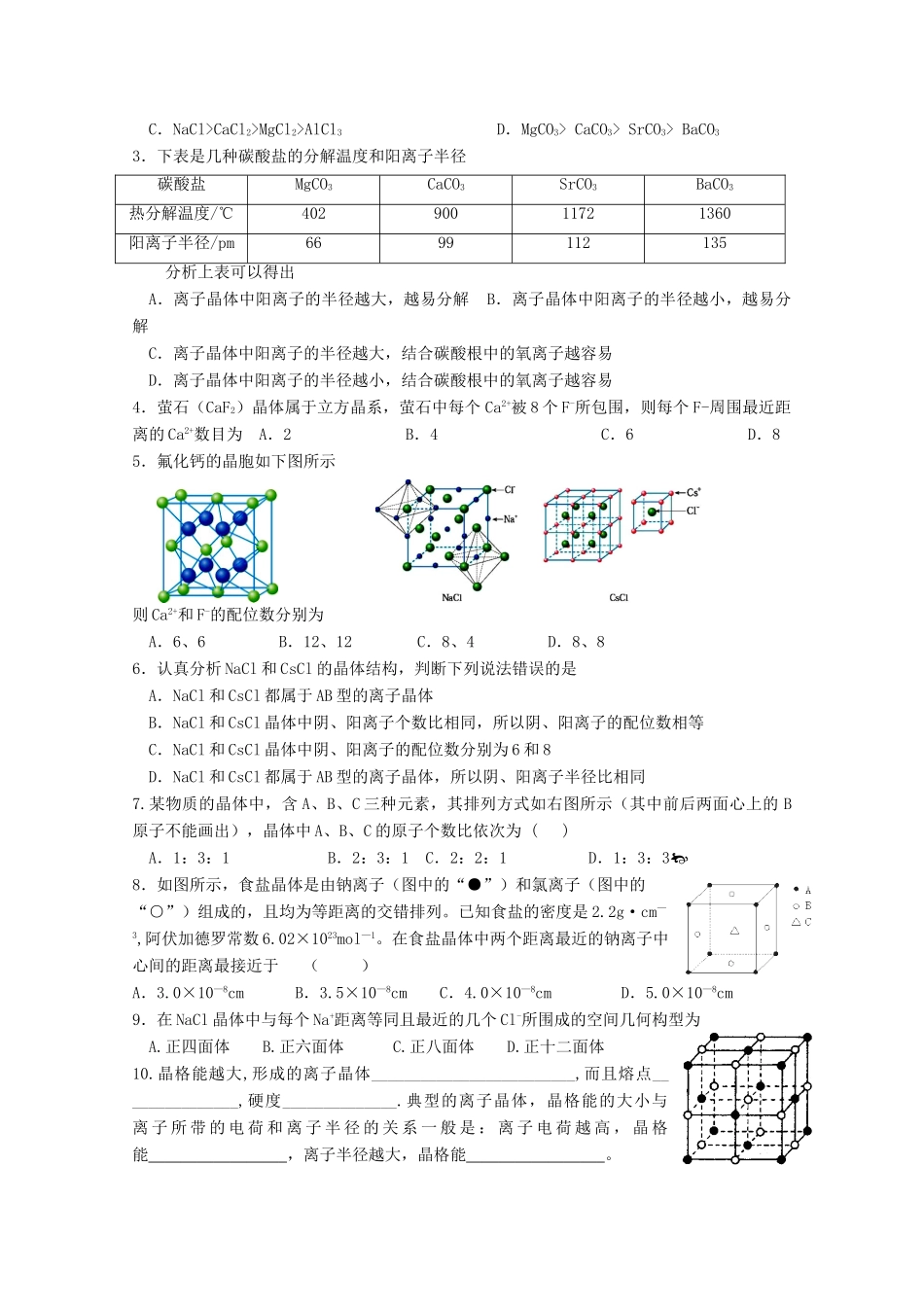
《选修三第三章第四节 离子晶体》导学案(第 2 课时)学习时间 2011 — 2012 学年上学期 周【课标要求】 知识与技能要求:通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。【复 习】:四种类型晶体的比较:晶体类型离子晶体分子晶体原子晶体金属晶体构成粒子粒子间相互作用硬度熔沸点导电性溶解性典型实例【阅读与思考】:阅读教材 P80 晶格能及讨论、分析表 3-8 可得出哪些结论?,晶格能的大小与离子晶体的熔点有什么关系?离子晶体的晶格能与哪些因素有关?1、定义:_________________________________2、规律:(1)离子电荷越大,离子半径越小的离子晶体的晶格能越大。[ (2)晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。【科学视野】阅读 P81---科学视野,从中你知道了什么? 【典例解悟】1.离子晶体熔点的高低决定于阴、阴离子之间的距离、晶格能的大小,据所学知识判断 KCl、NaCl、CaO、BaO 四种晶体熔点的高低顺序是( )A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaOC.CaO>BaO>KCl>NaCl D.CaO>BaO>NaCl>KCl2.NaF、NaI、MgO 晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是物质①NaF②NaI③MgO离子电荷数112离子间距离/10-10m2.313.182.10A.①>②>③ B.③>①>② C.③>②>① D.②>①>③3. NaCl 晶体模型如下图所示,在 NaCl 晶体中,每个 Na+周围同时吸引________个 Cl-, 每 个 Cl -周 围 也 同 时 吸 引 着 ________ 个 Na +; 在 NaCl 晶 胞 中 含 有 ________ 个 Na+、________个 Cl-,晶体中每个 Na+周围与它距离最近且相等的 Na+共有________个。【对点练习】1.决定离子晶体结构的重要因素是A.阳离子的半径 B.阴离子的半径 C.正负离子的半径比 D.正负离子的电荷比2.离子晶体之间的决定于离子键的大小,下列按离子键由大到小排列的是A.NaF>NaCl>NaBr>NaI B.Na2O >Na2S>NaCl>NaIC.NaCl>CaCl2>MgCl2>AlCl3 D.MgCO3> CaCO3> SrCO3> BaCO33.下表是几种碳酸盐的分解温度和阳离子半径碳酸盐MgCO3CaCO3SrCO3BaCO3热分解温度/℃40290011721360阳离子半径/pm6699112135分析上表可以得出A.离子晶体中阳离子的半径越大,越易分解 B.离子晶体中阳离子的半径越小,越易分解C.离子晶体中阳离子的半径越大,结合碳酸根中的氧离子越容易D.离子晶体中阳离子的半径越小,结合碳酸根中的氧离子越容易4.萤石(CaF2)...