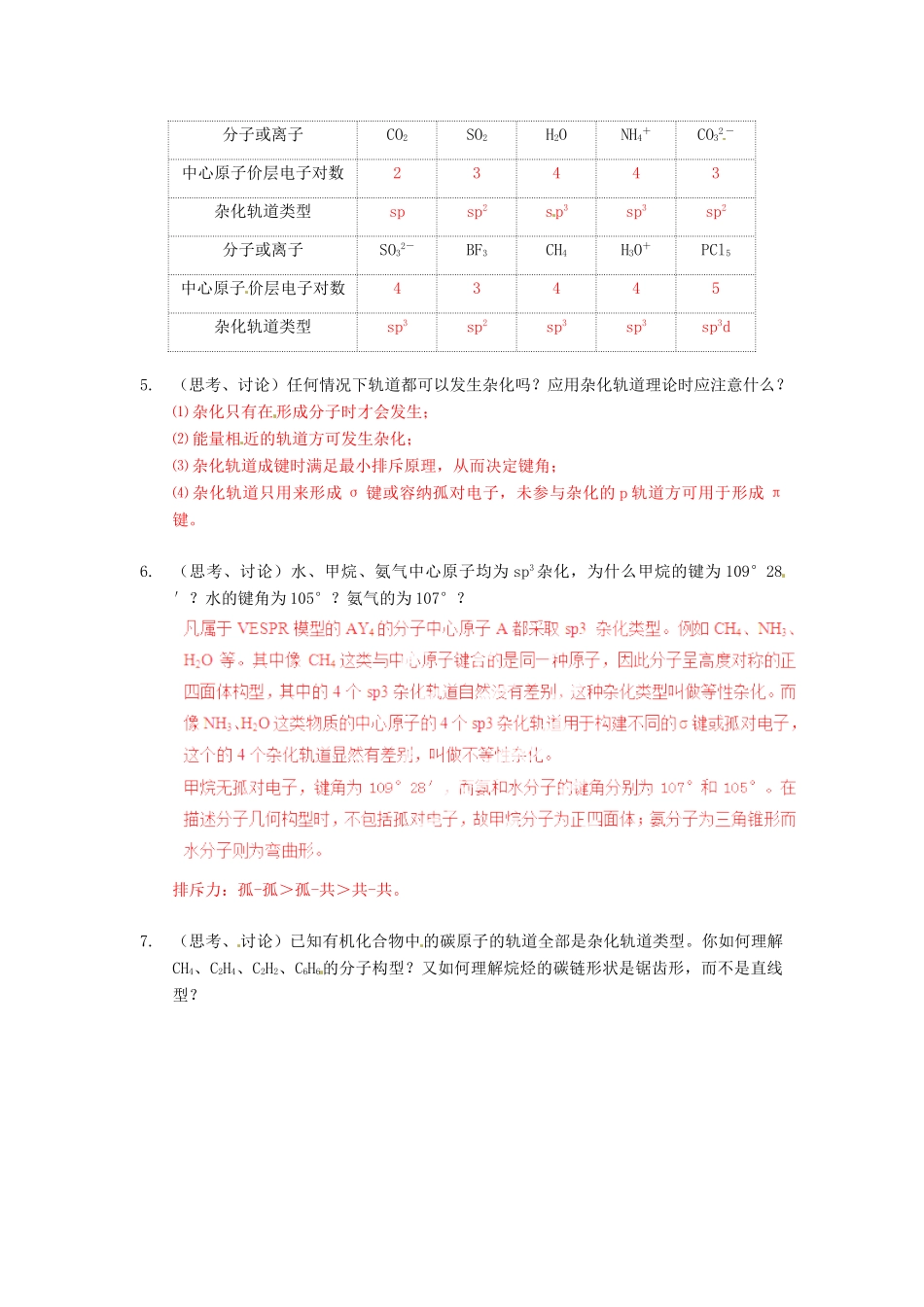
2013 年高考化学一轮复习教学教案:2.2《分子的立体构型》第 2 课时(人教版选修 3)学习目标:1.认识杂化轨道理论的要点;2.进一步了解有机化合物中碳的成键特征;3.能根据杂化轨道理论判断简单分子或离子的构型。导学提纲:1.(自学、讨论)鲍林提出杂化轨道理论的目的是什么?什么是杂化轨道?提出杂化轨道理论的目的:合理解释分子的空间构型。在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。2.(自学、讨论)甲烷分子的轨道是如何形成的?3.(思考、讨论)阅读教材 P39~40,并查阅相关资料,请思考:轨道进行杂化时,轨道的数量、能量、以及在空间的分布(形状)是否发生了变化?如果变化,又是如何改变的?请分别以 sp、sp2、sp3杂化轨道为例说明。轨道进行杂化时,轨道的数量没有发生改变,但轨道的能量、以及在空间的分布(形状)均发生了变化。sp 杂化:同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。杂化轨道间的夹角为 180°,分子的几何构型为直线形。sp2杂化:同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 3 个 sp2 杂化轨道。杂化轨道间的夹角为 120°,分子的几何构型为平面正三角形。sp3杂化:1 个 s 轨道和 3 个 p 轨道会发生混杂,得到 4 个相同的 sp3杂化轨道。杂化轨道间的夹角为 109°28′,分子的空间正四面体或 V 型、三角锥型。4.(思考、讨论)怎样判断有几个轨道参与了杂化?中心原子杂化 轨道的类型与价层电子对互斥理论(VSEPR)中的“价 层电子对”有何对应关系?中心原子上的价层电子对为 2、3、4、5、6 时,该中心原子形成的分别是什么样的杂化轨道?中心原子的孤电子对数与相连的其他原子数之和(即:孤电子对数+σ 键电子对),就是杂化轨道数。杂化轨道数也就是中心原子价层电子对数。【练一练】 分子或离子CO2SO2H2ONH4+CO32 -中心原子价层电子对数23443杂化轨道类型spsp2sp3sp3sp2分子或离子SO32-BF3CH4H3O+PCl5中心原子价层电子对数43445杂化轨道类型sp3sp2sp3sp3sp3d5.(思考、讨论)任何情况下轨道都可以发生杂化吗?应用杂化轨道理论时应注意什么?⑴ 杂化只有在形成分子时才会发生;⑵ 能量相近的轨道方可发生杂化;⑶ 杂化轨道成键时满足最小排斥原理,从而决定键角;⑷ 杂化轨道只用来形成...