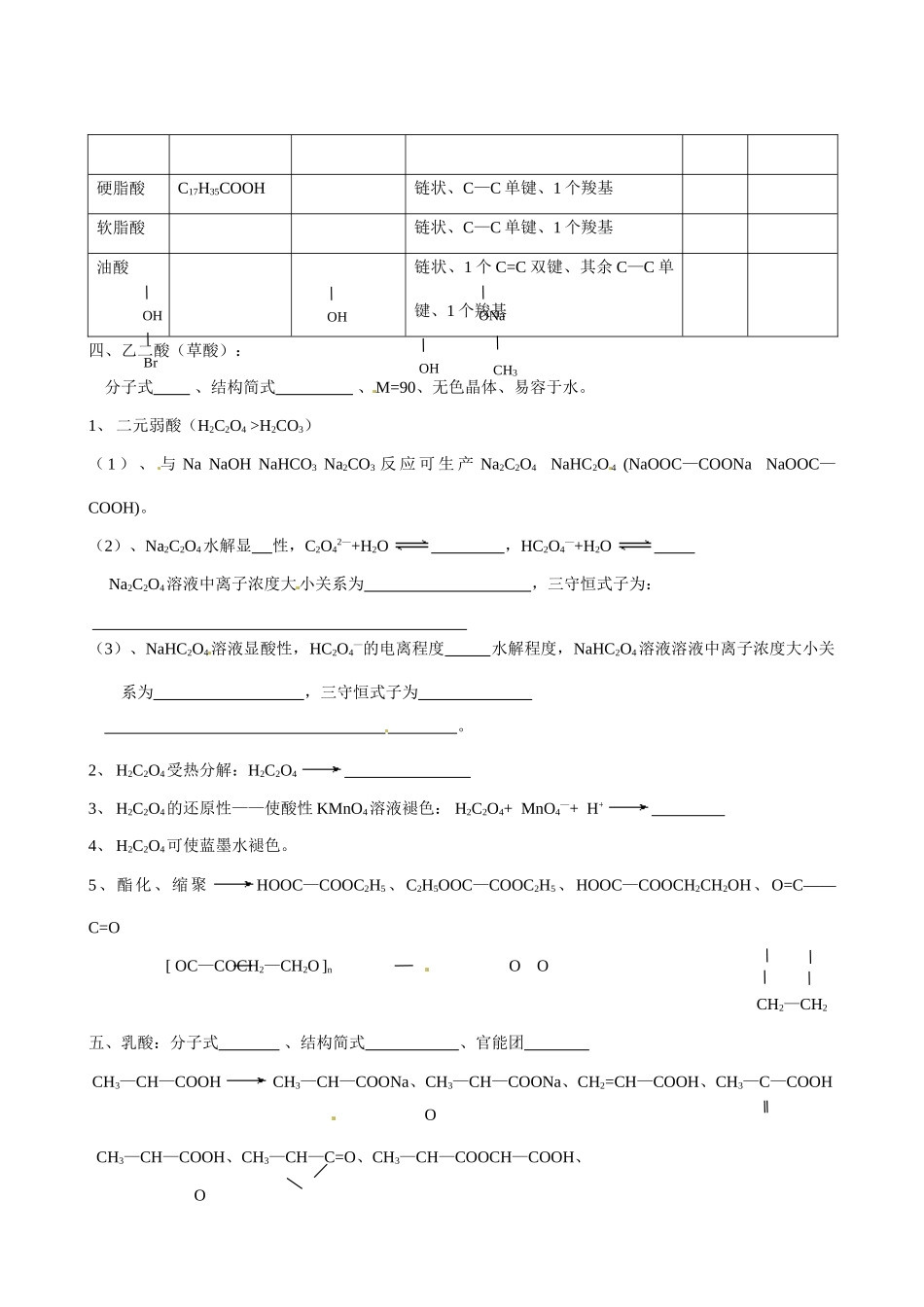
四川省内江市威远县威远中学 2014 高中化学《羧酸和酯》学案 新人教版选修 5一、二、酯化实验1、 原理——酸脱—OH、醇脱—H——取代反应——浓 H2SO4(催化、吸水)、加热 CH3COOH+H—18O—CH2CH3 2、 装置:右图示,甲乙丙也用于制乙酸乙酯。3、 反应器中加入试剂的顺序 或 ,并边加边摇匀。4、 乙醇过量的目的 。5、 反应器中加入碎瓷片的目的 。6、 加热的目的:①加快酯化反应速度,②蒸馏出乙酸乙酯是平衡右移、提高原料转化率(或产物产率)。7、 甲图左导管较长,作用是① 、② ;右球形导管的作用:导气、冷凝乙酸乙酯蒸气以及 。8、分离出右试管中乙酸乙酯的方法是: 。例 1、除去乙酸乙酯中少量乙酸的方法是: 。例 2、除去乙醇中少量乙酸的方法:加入 然后 。例 3、除去乙醇中少量 H2O 的方法是:加入 然后 。二、甲酸(蚁酸):分子式 ,结构式 ,结构简式 ,官能团 无色刺激性气味液体,易溶于水。三、高级脂肪(链状)酸:表达式分子式结构特点状态水溶性硬脂酸C17H35COOH 链状、C—C 单键、1 个羧基软脂酸链状、C—C 单键、1 个羧基油酸链状、1 个 C=C 双键、其余 C—C 单键、1 个羧基四、乙二酸(草酸):分子式 、结构简式 、M=90、无色晶体、易容于水。1、 二元弱酸(H2C2O4 >H2CO3)( 1 ) 、 与 Na NaOH NaHCO3 Na2CO3 反 应 可 生 产 Na2C2O4 NaHC2O 4 (NaOOC—COONa NaOOC—COOH)。(2)、Na2C2O4水解显 性,C2O42—+H2O ,HC2O4—+H2O Na2C2O4溶液中离子浓度大小关系为 ,三守恒式子为: (3)、NaHC2O4溶液显酸性,HC2O4—的电离程度 水解程度,NaHC2O4溶液溶液中离子浓度大小关系为 ,三守恒式子为 。2、 H2C2O4受热分解:H2C2O4 3、 H2C2O4的还原性——使酸性 KMnO4溶液褪色: H2C2O4+ MnO4—+ H+ 4、 H2C2O4可使蓝墨水褪色。5、酯化、缩聚HOOC—COOC2H5、C2H5OOC—COOC2H5、HOOC—COOCH2CH2OH、O=C——C=O [ OC—COCH2—CH2O ]n O OCH2—CH2五、乳酸:分子式 、结构简式 、官能团 CH3—CH—COOH CH3—CH—COONa、CH3—CH—COONa、CH2=CH—COOH、CH3—C—COOH OCH3—CH—COOH、CH3—CH—C=O、CH3—CH—COOCH—COOH、 O OHOHONaBr OHCH3六、饱和一元脂肪(链状)酸、酯:(1)、通式 (酸 n≥1、酯 n≥2)(2)、同分异构体书写:酸——先写碳链异构,后将端点碳变为—COOH 成为酸; 酯——先写碳链异构,后...