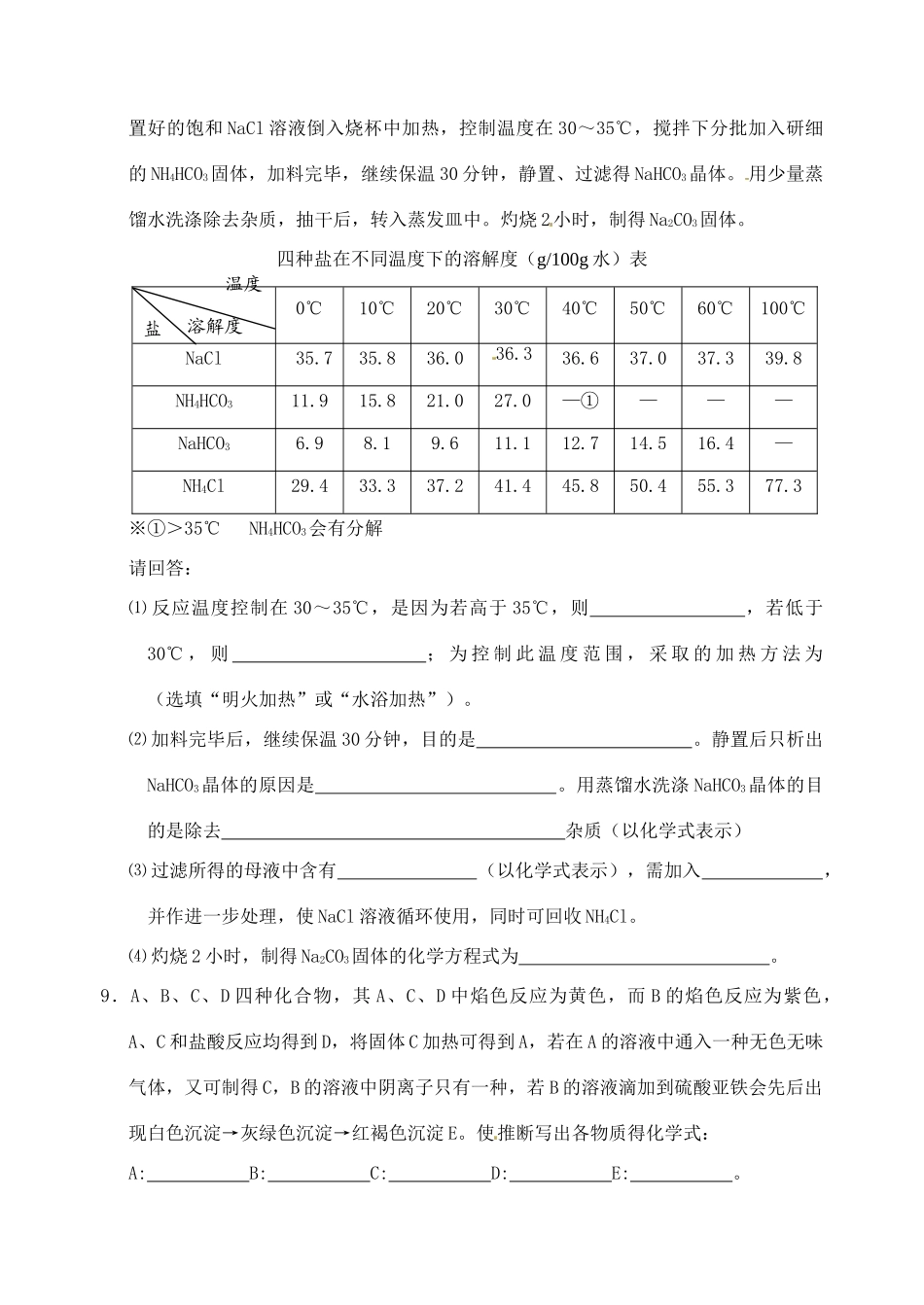
江苏省如皋市第二中学 2013-2014 学年高中化学 几种重要的金属化合物检测 新人教版必修 1【本节检测】1.下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是① 金属钠在纯氧中燃烧;② FeSO4溶液中滴入 NaOH 溶液,并在空气中放置一段时间;③ FeCl3溶液中滴入 KSCN 溶液④无水硫酸铜放入医用酒精中。A.②③①④ B.③②①④ C.③①②④ D.①②③④2.某物质灼烧时,焰色为黄色,下列判断正确的是A.该物质一定是钠的化合物 B.该物质一定含钠元素C.该物质一定是金属钠 D.不能确定该物质是否含钾元素3.下列说法错误的是A.仅用 KSCN 可以检验 Fe2+ B.可以用 NaOH 溶液检验 Fe3+C.通过化合反应可以得到 Fe(OH)3 D.通过化合反应可以得到 FeCl24.能与 Fe3+反应,且能证明 Fe3+具有氧化性的物质是①KSCN ②Fe ③FeCl2 ④Cu ⑤NaOHA.④⑤ B.②④ C.①③ D.①②③5.某溶液中加入 KSCN 溶液无 明显现象,再滴加氯水,立即变成红色,说明原溶液中一定含有A. Fe3+ B.Fe2+ C.Cu2+ D.Zn2+6.甲、乙、丙三种不同浓度的稀硫酸,分别跟等物质的量的铝、碳酸氢钾、碳酸钾恰好完全反应,所耗去甲、乙、丙三种酸的体积比为 1:2:3,则甲、乙、丙三种酸物质的量浓度之比为A.1:1:1 B.3:1:2 C.6:2:3 D.18:3:47.将足量的铁粉投入到盐酸和氯化铜的混合溶液中,完全反应后,过虑、烘干,称得滤渣的质量与加入的铁粉的质量相等,则原混合溶液中 c(H+)和 c(Cl—)之比为A.1:8 B.2:9 C.1:7 D.2:78.根据侯德榜制碱法原理并参考下表数据,实验室制备纯碱 Na2CO3的主要步骤是:将配置好的饱和 NaCl 溶液倒入烧杯中加热,控制温度在 30~35℃,搅拌下分批加入研细的 NH4HCO3固体,加料完毕,继续保温 30 分钟,静置、过滤得 NaHCO3晶体。 用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中。灼烧 2小时,制得 Na2CO3固体。四种盐在不同温度下的溶解度(g/100g 水)表0℃10℃20℃30℃40℃50℃60℃100℃NaCl 35.735.836.036.336.637.037.339.8NH4HCO311.915.821.027.0—①———NaHCO36.98.19.611.112.714.516.4—NH4Cl29.433.337.241.445.850.455.377.3 ※①>35℃ NH4HCO3会有分解请回答:⑴ 反应温度控制在 30~35℃,是因为若高于 35℃,则 ,若低于30℃ , 则 ; 为 控 制 此 温 度 范 围 , 采 取 的 加 热 方 法 为 (选填“明火加热”或“...