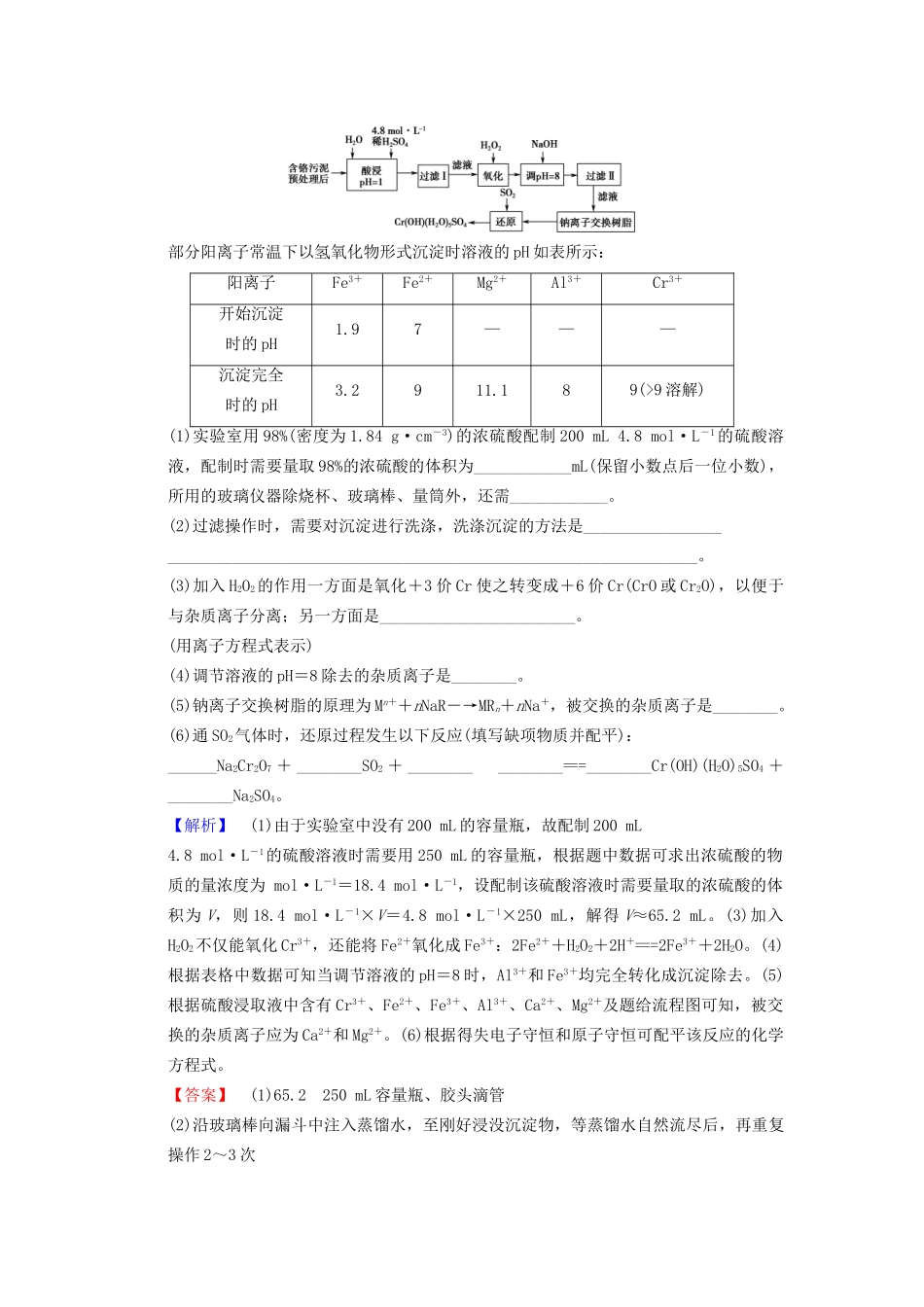
专题突破训练(一)化学工艺流程试题的突破方略1.(2016·全国Ⅲ卷,T26节选)过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:过氧化钙的制备CaCO3――――――――――→滤液――――――→过滤,白色结晶(1)步骤①的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈________性(“”“”“”填酸、碱或中)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是________________。(2)步骤②中反应的化学方程式为____________________________________________________________________________________________________,该反应需要在冰浴下进行,原因是__________________________________。(3)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是______________________________________________________________。(4)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是_____________________,产品的缺点是________。【解析】(1)步骤①中逐滴加入稀盐酸,至溶液中尚存有少量固体,该固体为CaCO3,溶液中含有CaCl2,由于溶解了生成的CO2,溶液呈弱酸性。将溶液煮沸,可排出溶解的CO2,防止与后续加入的氨水及生成的CaO2反应。(2)滤液中含有CaCl2,加入氨水和双氧水在冰浴条件下反应,经过滤得到白色晶体(CaO2),结合元素守恒推知步骤②中反应还生成NH4Cl和H2O,化学方程式为CaCl2+2NH3·H2O+H2O2+6H2O===CaO2·8H2O↓+2NH4Cl或CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2O。H2O2不稳定,受热易分解生成H2O和O2,故该反应在冰浴条件下进行,其目的是防止H2O2受热分解。(3)过氧化钙微溶于水,能溶于酸,白色结晶(CaO2)可依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是去除结晶表面水分。(4)将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。与第一种方法相比,其优点是工艺简单、操作方便;产品的缺点是纯度较低。【答案】(1)酸除去溶液中的CO2(2)CaCl2+2NH3·H2O+H2O2+6H2O===CaO2·8H2O↓+2NH4Cl或CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2O温度过高时双氧水易分解(3)去除结晶表面水分(4)工艺简单、操作方便纯度较低2.(2018·长郡中学学生选拔考试)某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:阳离子Fe3+Fe2+Mg2+Al3+Cr3+开始沉淀时的pH1.97———沉淀完全时的pH3.2911.189(>9溶解)(1)实验室用98%(密度为1.84g·cm-3)的浓硫酸配制200mL4.8mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为____________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需____________。(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________________________________________________________________________________。(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO或Cr2O),以便于与杂质离子分离;另一方面是________________________。(用离子方程式表示)(4)调节溶液的pH=8除去的杂质离子是________。(5)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________。(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):______Na2Cr2O7+________SO2+________________===________Cr(OH)(H2O)5SO4+________Na2SO4。【解析】(1)由于实验室中没有200mL的容量瓶,故配制200mL4.8mol·L-1的硫酸溶液时需要用250mL的容量瓶,根据题中数据可求出浓硫酸的物质的量浓度为mol·L-1=18.4mol·L-1,设配制该硫酸溶液时需要量取的浓硫酸的体积为V,则18.4mol·L-1×V=4.8mol·L-1×250mL,解得V≈65.2mL。(3)加入H2O2不仅能氧化Cr3+,还能将Fe2+氧化成Fe3+:2Fe2++H2O2+2H+===2Fe3++2H2O。(4)根据表格中数据可知当调节溶液的pH=8时,Al3+和Fe3+...